|
Circular
02 de 2008 de la CNPM
Pequeñas inconsistencias de la Circular 02/2008 de la
CNPM
La Comisión
Nacional de Precios de Medicamentos (CNPM) acaba de
publicar la Circular 02 de 2008 que establece las
primeras "clasificaciones terapéuticas
relevantes" e incluye algunos antiretrovirales en
régimen de "libertad regulada". Decimos que
tiene pequeñas inconsistencias porque en KALETRA no
especifica concentraciones disponibles ni la forma
farmacéutica solución oral, mientras que en
PREZISTA, el Darunavir de Janssen, lista seis (6)
veces el mismo producto, pese a que tiene un solo
registro sanitario y una sola concentración.
¿Porqué en un caso NO se incluyen variaciones
importantes de concentraciones y forma farmacéutica,
mientras en el otro se lista 6 veces el mismo producto
por simples cambios de presentación comercial?
1.
Pequeñas inconsistencias mencionadas en
BIS-BCM_01/2009:
En
nuestro anterior boletín BIS-BCM_01/2009,
mostramos cómo la nueva Circular
02 de 2008 (Diario Oficial No. 47.193 del
04dic2008), después de 2 años y 3 meses de vigencia
de la Circular
04 de 2006, decidió definir la primera
"Clasificación Terapéutica Relevante" e incluir
algunos antiretrovirales en régimen de "libertad
regulada"(?). Es decir que, después de más
de dos años, la Comisión Nacional de Precios de Medicamentos,
no presentó ningún estudio de precios de pases de
referencia, decidió simplemente que siete (7)
antiretrovirales tienen seis (6) importadores o
productores exclusivos "por lo que prima
fascie superan
el valor determinado para el índice de concentración
de Herfindhal-Hirsman"
(refiriendose a un índice de Herfindahl-Hirschmann
superior a 0,45).
Los
antiretrovirales -que según el Art.13° de la
Circular 04 de 2006 estaban en régimen de
"libertad regulada"
y según el Art. 2° de la Circular 02 de 2008 pasan
otra vez a régimen de "libertad regulada"-
son: KALETRA® Lopinavir + Ritonavir de Abbott, TELZIR®
Fosamprenavir y KIVEXA® asociación Abacavir +
Lamivudina de GlaxoSmithKline, REYATAZ® Atazanavir de
BristolMyersSquibb, PREZISTA® Darunavir de Janssen,
FUZEON® Enfuvirtida de Roche e ISENTRESS®
Raltegravir de Frosst MS&D.
2.
¿Porqué no están las "CAPSULAS" de
KALETRA que acaban de ingresar al POS?:
La
siguiente imagen, muestra lo que decimos en el
encabezamiento:
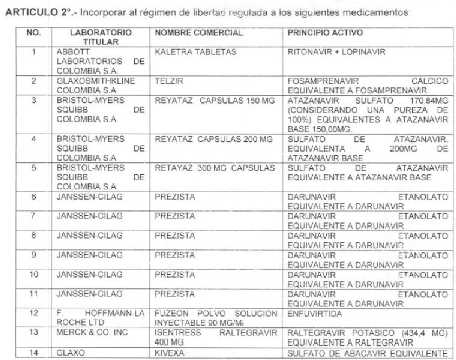
Nótese que KALETRA
está solo en tabletas y PREZISTA está 6 veces con
los mismos datos.
Comparando
estos productos con la base de datos de registros
sanitarios vigentes del INVIMA vemos que:
-
KALETRA® tabletas (1). Tiene registro sanitario
vigente también en cápsulas (Lopinavir 133.3 mg +
Ritonavir 33.3 mg, que fue el último en ingresar al
POS) y solución oral. ¿Será que la norma aplica
solo a la forma farmacéutica de tabletas?
- PREZISTA® (6, 7, 8, 9, 10, 11) Tiene un solo
registro sanitario, una sola concentración y una sola
forma farmacéutica. Viene en frascos por 28, 60, 90,
100, 120 y 150 tabletas. ¿Será que la norma aplica
para cada Código Unico de Medicamento (CUM)?
Sin pecar de paranoicos, es razonable preguntarnos si
existe alguna razón especial por la cual KALETRA en
cápsulas, no está en la lista. Ya dijimos que la
forma farmacéutica "cápsulas" y
concentración Lopinavir 133.3 mg + Ritonavir 33.3 mg
fue la que más recientemente ingresó al Plan
Obligatorio de Salud (POS). Y anecdóticamente,
añadamos que fue esta forma farmacéutica, con estas
concentraciones, la que Biotoscana registró como
LOPINAR, producto al que le fue retirado el registro
sanitario por orden del Juzgado 42 Civil del Circuito
de Bogotá.
|
