|
Según OBSERVAMED-FMC -tomando en cuenta que el mercado farmacéutico total es de 10
billones según reportes de los laboratorios a SISMED de
2014- una Resolución que afectará el 10%
de dicho mercado (ventas por 1 billón anual) y afectará los precios de esos
medicamentos, el acceso a los mismos y la sostenibilidad del sistema,
debería demostrar su necesidad, oportunidad y pertinencia, con evidencias sólidas.
3.
Comparación de
principios activos incluidos en listas de la Comisión Revisora y el proyecto
de Resolución
El documento de OBSERVAMED-FMC utiliza la comparación de las listas de principios activos del Anexo
Técnico 2 del Proyecto de resolución con las Actas No. 05 de 2014 (numeral
3.11.1. pág.688) y 10 de 2015 (numeral
3.11.1. pág.395), para expresar sus dudas sobre la oportunidad y
pertinencia de un "cambio extremo" que en lugar de actualizar la
normativa existente en el país -respetando lo rescatable de la Resolución
1400 de 2001 (ARMI)
y la experiencia colombiana en este campo- la reemplaza por una transcripción
del documento internacional de referencia "literalmente sin considerar el contexto y necesidades locales"
como dice el CIMUN.
En
la comparación de las 3 listas, el documento de OBSERVAMED-FMC llama la atención, tanto sobre detalles del Anexo
Técnico 2 que denotan descuido (principios activos repetidos, orden alfabético
deficiente, etc.), como sobre los posibles conflictos con la normatividad
vigente y posibles efectos perjudiciales de la ampliación brusca y anticipada
de inclusiones de nuevos principios activos.
Sobre
la posibilidad de conflicto con la normatividad vigente, dice que las listas
consignadas en las Actas No. 05 de 2014 y 10 de 2015 de la Comisión Revisora de medicamentos, fueron elaboradas con
"suficiencia técnica y legitimidad normativa" por la
instancia específica legalmente encargada de esa función. En contraste -dado que la normativa vigente faculta
específicamente a la Comisión Revisora para que defina las inclusiones o
exclusiones de principios activos en dichas listas- la
ampliación drástica que propone el Anexo Técnico 2 de la Resolución
propuesta, puede no tener " suficiencia técnica y legitimidad
normativa" porque
las normas vigentes no contemplan esa forma de "imponerse" sobre la
Comisión Revisora. Dicho en otras palabras, los problemas desaparecerían si
el proyecto fuese una actualización normativa y la lista fuese una decisión
de la Comisión Revisora.
El documento de OBSERVAMED-FMC sostiene que las recomendaciones de la OMS, que “en 2015 actualizó la guía con
recomendaciones para productos farmacéuticos multifuente (genéricos) anexo 7
del informe 40”, no son vinculantes. Es decir, no obligan a que, países con la
experiencia, capacidad y necesidades de Colombia, tengan que ajustarse
literalmente a las listas que la OMS incluye en sus recomendaciones.
4. Inclusión
"precoz" de Principios Activos aún no disponibles y protegidos por Decreto 2085
Por lo dicho en el anterior párrafo, OBSERVAMED-FMC considera que la
inclusión "precoz" en el Anexo Técnico 2, de moléculas aún no disponibles en Colombia (según SISMED) y
protegidas por Decreto 2085 -por ejemplo CRIZOTINIB
(con comparador de referencia Xalkori de Pfizer) e IBRUTINIB (comparador de
referencia Imbruvica de Janssen Cilag)- no corresponde a la problemática
actual del país. Si ambos principios activos están protegidos
por Decreto 2085 y la norma les garantiza cinco años de exclusividad
¿corresponde a una necesidad nacional su inclusión en la lista, con cinco años
de anticipación?. Si no se trata de un problema de transcripción de la
lista y aún nadie puede registrar genéricos ¿Que sentido tiene incluirlos
desde ya en la lista?.
Consideraciones similares pueden hacerse con 27
Principios Activos (entre ellos 11 “Protein kinase inhibitors” o NIBs) de la lista del Anexo Técnico 2 que de acuerdo con el
último informe de SISMED no cuentan con competidores disponibles en Colombia.
Si la lista del Anexo Técnico 2 del Proyecto de Resolución contiene
inclusiones "preventivas", conviene resaltar que las listas de la Comisión Revisora de
Medicamentos del INVIMA no incurrían en esa práctica. Es decir, las
listas consignadas en las Actas No. 05 de 2014 y 10 de 2015 de la Comisión Revisora no incluyen Principios Activos sin competidores disponibles.
En resumen, no se discute la racionalidad científica de estas
inclusiones, sino su anticipación y discutible pertinencia. Todo puede corresponder a un
loable esfuerzo de aseguramiento de calidad, pero los descuidos pueden
funcionar como barreras anticipadas o innecesarias a la entrada de competidores
y oponerse a las metas del acceso que comparten la Política Farmacéutica Nacional, el Plan
Nacional de Desarrollo y la Ley Estatutaria.
5. El caso
de IMATINIB y las implicaciones colaterales del proyecto de Resolución
El caso de IMATINIB es objeto de seguimiento
especial por parte de la sociedad civil, debido a la patente de mala calidad otorgada por el Consejo de Estado a
GLIVEC y la petición de declaratoria de
interés público que –por acción de Misión Salud, IFARMA y CIMUN- cursa
ante el Ministerio de Salud.
Tal como puede verse en la página de seguimiento
de IMATINIB-GLIVEC en Colombia, la patente que el
Consejo de Estado ordenó otorgar a la sal beta de IMATINIB,
estuvo rodeada de irregularidades que son materia
de investigación y controversia (la no contestación
de la demanda por parte de la Superintendencia de
Industria y Comercio SIC, la ausencia de
peritazgos independientes del INVIMA o la academia en el proceso,
etc.).
El Anexo Técnico 2 del Proyecto de Resolución, incluye IMATINIB con comparador de referencia GLIVEC de
Novartis, es decir, define como comparador de referencia
a la forma
beta patentada por Novartis. En el campo de los
resultados concretos, esto es favorecer las pretenciones de
Novartis, pese a que en un informe reciente que hace parte del proceso de declaración
de interés público (ver ARMI)
el INVIMA reconoció que en ninguno de los cuatro (4)
expedientes de GLIVEC se registró polimorfo alguno (ningún producto
-excepto IMATERO
de HETERO LABS LIMITED- registró la
forma beta. De 26 productos, solo 1 obtuvo registro sanitario con la
forma beta y solo 3 obtuvieron el registro sanitario con la
forma alfa). Ver fragmento en gráfico N°3.
Gráfico N°3: Informe INVIMA sobre registros de IMATINIB dice
que expedientes de GLIVEC no registran polimorfo
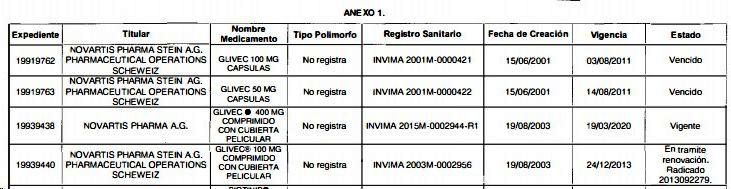
Además del tema de aseguramiento de calidad -tema por el cual este
principio activo está en la lista del Acta 10 de 2015 de la Comisión Revisora
y las recomendaciones para productos farmacéuticos multifuente (genéricos) anexo 7
del informe 40 de la OMS- el Proyecto de Resolución, debió tomar en cuenta
la controversia existente en Colombia y el INVIMA
pronunciarse oficialmente sobre el tema de polimorfos, antes
de definir como comparador de
referencia a GLIVEC de Novartis (la forma beta que está patentada). Se trata evidentemente de asegurar
la calidad de los genéricos, pero, al definir comparadores
de referencia, deben tomarse en cuenta y resolverse los
asuntos pendientes y controversiales. Estas definiciones
corresponden a la adecuación nacional de las
recomendaciones de la OMS y deben asumirse con máxima responsabilidad porque
cada decisión puede traducirse en salud, vidas humanas y
sobrecostos. Un informe
reciente del mismo Ministerio de Salud y Protección Social (ARMI)
estima sobrecostos de 97.000
millones a 130.000
millones por la salida de los genéricos de IMATINIB.
Envíe sus aportes y
comentarios a observamed.fmc@gmail.com
o trine en @OBSERVAMED
Sobre
conflictos de interés:
La iniciativa "Elijamos
Sabiamente" de la Federación
Médica Colombiana FMC y el Colegio
Nacional de Químicos Farmacéuticos de Colombia CNQFC, no recibe ninguna retribución monetaria, ni en
especie, de ninguna entidad pública ni privada, que pueda comprometer
la independencia de sus investigaciones e informes.
Participe
escribiéndonos a observamed.fmc@gmail.com
|