|
2.
"Uso concomitante obligatorio" de DAKLINZA
(Daclatasvir) y SUNVEPRA (Asunaprevir)
La siguiente tabla muestra los fragmentos pertinentes de las indicaciones
aprobadas en Colombia para ambos productos. El texto resaltado
y en negrilla explica claramente lo que entendemos por "uso
concomitante obligatorio":
Indicación aprobada por
INVIMA para DAKLINZA
(Daclatasvir de BMS)
INDICACIONES: Daklinza® (daclatasvir) es un inhibidor del
complejo de replicación ns5a del virus de la hepatitis C (VHC)
indicado como alternativo para el tratamiento
de la infección crónica por el VHC en adultos con enfermedad hepática
compensada (incluyendo cirrosis), en combinación con: Sunvepra®
(asunaprevir) para pacientes con infección causada por el
genotipo 1b del vhc. No se recomienda el uso de esta combinación
en pacientes con polimorfismo n5sa dado que no hay evidencia
significativa de respuesta. Sunvepra® (asunaprevir), peginterferón
alfa y ribavirina para pacientes con infección causada por el
genotipo 1 ó 4 del VHC.
|
Indicación aprobada por
INVIMA para SUNVEPRA
(Asunaprevir de BMS)
INDICACIONES: sunvepra® (asunaprevir) es un inhibidor de proteasa ns3/4a del virus de la hepatitis C (VHC) indicado como alternativo para el
tratamiento de la infección crónica por el VHC en adultos con enfermedad hepática compensada (incluyendo cirrosis)
en combinación con: Daklinza® (daclatasvir), para pacientes con infección causada por el genotipo 1b del vhc. No se recomienda el uso de esta combinación en pacientes con polimorfismo n5sa dado que no hay evidencia significativa de respuesta. Daklinza®, peginterferón alfa y ribavirina
para pacientes con infección causada por el genotipo 1 ó 4 del VHC. Resaltado
y negrillas fuera del texto. |
3.
Bristol Myers Squibb retiró la NDA (New Drug Applications) de ASUNAPREVIR en
EEUU
Según la FDA, el 6 de octubre de 2014, Bristol Myers Squibb (BMS) retiró la NDA (New Drug Applications) 206844 de
ASUNAPREVIR (ver Complete Response)
Lo anterior implica que
cuando el INVIMA expidió la Resolución No. 2015029104
de 27 de Julio de 2015 AR
por la cual se otorga registro sanitario a SUNVEPRA
(Asunaprevir de BMS) y se confirma la protección por Decreto 2085 o "patente express"
para este producto (hasta el año 2020!), habían pasado ya diez (10)
meses de la decisión de BMS de retirar la NDA (New Drug Applications) 206844 de
ASUNAPREVIR ante la FDA.
Por los anteriores hechos, la Veeduría ciudadana VCACELAPSS radicó un derecho de petición ante el Ministerio de Salud sobre recobros con el medicamento ASUNAPREVIR y la pertinencia de su uso.
Y como ya se dijo antes, al no producirse ninguna respuesta, inició la respectiva acción de tutela que está próxima a definirse.
Ver derecho
de petición y radicado.
4. ASUNAPREVIR
(Sunvepra) pantalla
de análisis del principio activo
En la siguiente captura de la pantalla de seguimiento de principios activos,
pueden apreciarse las diferencias de manejo de ASUNAPREVIR por las autoridades
reguladoras de EEUU y Colombia:

1. Mientras Asunaprevir fue retirado por el
propio laboratorio en EEUU, en Colombia el IETS lo "evaluó"
favorablemente y fue premiado con protección del D.2085
2. La indicación aprobada por el INVIMA hace referencia exclusivamente
a su uso asociado con Daclatasvir. Otros usos no están autorizados
legalmente.
3. Los cálculos de costos del
tratamiento deben incluir los costos de Daclatasvir. Por esto, el costo de
cada tratamiento se estima en más de 90 millones
4. La asociación Asunaprevir
+ Daclatasvir
se introdujo a finales de 2015 y hasta el 2° trimestre de 2016 vendió 20.000
millones (solo reportes del laboratorio)
5. Pese a lo anterior, ni Asunaprevir
ni Daclatasvir
fueron sometidos a ninguna forma de regulación de precios (ni referencia
internacional, ni PRUmC).
Pulse
click aquí para ver pantalla de seguimiento del producto SUNVEPRA por nombre
comercial.
5. DACLATASVIR
(Daklinza) pantalla
de análisis del principio activo
En la siguiente captura de la pantalla de
seguimiento de principios activos, pueden apreciarse las características del
manejo de DACLATASVIR por las autoridades reguladoras colombianas:
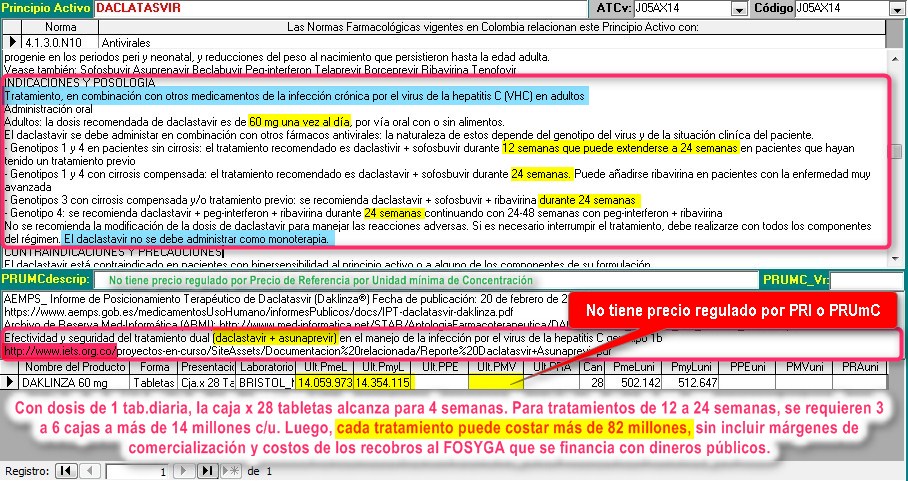
1. Pese a la tutela interpuesta por la FMC el
INVIMA sigue sin publicar información para prescribir. En todo caso el
registro sanitario no incluye posología.
2. La indicación aprobada por el INVIMA hace referencia exclusivamente
a su uso asociado con Asunaprevir. Otros usos no están autorizados
legalmente.
3. Los cálculos de costos del
tratamiento deben incluir los costos de Asunaprevir. Por esto, el costo de
cada tratamiento se estima en más de 90 millones
4. La asociación Daclatasvir
+ Asunaprevir
se introdujo a finales de 2015 y hasta el 2° trimestre de 2016 vendió 20.000
millones (solo reportes del laboratorio)
5. Pese a lo anterior, ni Daclatasvir
ni Asunaprevir fueron
sometidos a ninguna forma de regulación de precios (ni referencia
internacional, ni PRUmC).
Pulse
click aquí para ver pantalla de seguimiento del producto DAKLINZA por nombre
comercial.
CONCLUSIÓN
1. El INVIMA debe esclarecer definitivamente la situación de la asociación
ASUNAPREVIR+DACLATASVIR
2. Deben identificarse las causas el retiro de ASUNAPREVIR en EEUU y definir
si aplican en Colombia
3. Si se justifica, este producto debe llamarse a revisión de oficio y debe
suspenderse su comercialización
4. Debe replantearse el registro sanitario de DACLATASVIR para incluir
asociaciones realmente efectivas y seguras
5. Deben adoptarse medidas correctivas en INVIMA e IETS con miras a la
aplicación del Artículo 72 del PND.
Envíe sus aportes y
comentarios a observamed.fmc@gmail.com
o trine con @OBSERVAMED
Sobre
conflictos de interés:
La iniciativa "Elijamos
Sabiamente" de la Federación
Médica Colombiana FMC y el Colegio
Nacional de Químicos Farmacéuticos de Colombia CNQFC, no recibe ninguna retribución monetaria, ni en
especie, de ninguna entidad pública ni privada, que pueda comprometer
la independencia de sus investigaciones e informes.
|