|
En
resumen, la Circular
01 de 2016 incrementa
indiscriminadamente un 11.11% en el precio regulado de 815 presentaciones
(sin incluir 14 presentaciones de Glivec de la Resolución 718 de 2015 y 3
presentaciones de Kaletra de la Circular 06 de 2013). Del total de 832 presentaciones reguladas, 557 no presentan
ventas reportadas a SISMED, por lo cual son solo 275 las presentaciones
efectivamente reguladas (ver Gráfico N°1). Esta Circular se limita a
recalcular los ajustes de precios de la Resolución 0718
de 2015 y fija "Precios de
Referencia por Unidad Mínima de Concentración" para 111 principios
activos (donde algunos PRUmC resultan siendo inocuos).
3.
Las tareas urgentes que siguen a la Circular 01 de 2016
La Circular
01 de 2016 fija un plazo de sesenta (60) días calendario
"para revisar la procedencia del ajuste del precio del medicamento Glivec" y aclara que
"los medicamentos incluidos en la Circular 04 de 2012 serán sometidos a referenciación internacional de precios de conformidad con lo establecido en el artículo
9 de la Circular 03 de 2013". Es
decir, define las tareas más urgentes que siguen a continuación.
Sin duda, las ventajas de la nueva metodología de regulación de precios para
medicamentos especiales, con declaratoria de interés público, podrán verse
con el caso de GLIVEC:
Cuanto más próximo sea el nuevo precio regulado de GLIVEC al precio
propuesto de 140 pesos el miligramo, tanto más prestigio ganará la nueva
metodología.
Y
en cuanto a los precios de medicamentos incluidos en la Circular 04 de 2012,
urge someterlos a referenciación internacional a la brevedad posible, tanto
por su impacto económico, como porque presentan inconsistencias -por ejemplo,
precios absurdos de las presentaciones hospitalarias- que deben corregirse tan
pronto sea posible. Recordemos que el ministerio ya publicó un borrador que
sin duda les facilitará la tarea.
4.
Los precios exorbitantes de la "presión tecnológica" ya presente
A renglón seguido, deben regularse los
precios de los medicamentos con precios exorbitantes a los que se refiere el
Ministro Gaviria cuando habla de "presión tecnológica". Casos como
CANAKINUMAB (ILARIS de Novartis) indicado
en Artritis Idiopática Juvenil, cuyo Precio Unitario Promedio de la
Presentación PUPP de acuerdo con reportes a SISMED es de COP 31.021.760 (xcaja x1
vial, que el 2015 con solo 39 viales tuvo
ventas superiores a COP 1.209 millones) constituyen una verdadera
amenaza par la sostenibilidad financiera del sistema de salud.
|
Gráfico N°2: Falta regular más precios exorbitantes de
medicamentos
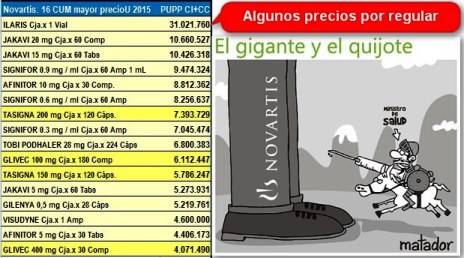 |
- MIGLUSTAT (ZAVESCA de Actelion-Biotoscana) Precio PUPP 27.893.661
(xcaja x90 cápsulas) que en 2014 y 2015 reportó ventas al sistema superiores
a COP 8.000 millones cada año;
- ALEMTUZUMAB (LEMTRADA de Genzyme-SanofiAventis) para Esclerosis Múltiple,
Precio PUPP 22.492.458 (xcaja x1 vial) que el 2015 con solo 45 viales
sumó COP 1.012 millones;
- PLERIXAFOR (MOZOBIL de Genzyme-SanofiAventis) para Linfoma NoH y Mieloma M.
Precio PUPP 18.235.512 (xcaja x1 vial) que el 2015 con 123 viales sumó
COP 2.243 millones;
- IPILIMUMAB (YERVOY de Bristol) Precio PUPP 14.888.631 (xcaja x1 vial)
que vendió al sistema más de COP 20.151 millones el 2014 y más de 25.668
millones el 2015;
- IBRUTINIB (IMBRUVICA de Janssen) para Leucemia Linfocítica Crónica, Precio
PUPP 14.400.000 (xcaja x90 cápsulas) y el 2015 con solo 70 cajas sumó
COP 1.008 millones;
- DACLATASVIR (DAKLINZA de Bristol) para Hepatitis C, Precio PUPP 14.354.115
(xcaja x28 tabletas) que el 2015 con solo 126 cajas tuvo ventas superiores a
COP 1.809 millones. Ver más casos en Boletín
BisBcm#23. |
El gráfico N°2
muestra la percepción que tiene la ciudadanía, de la correlación de fuerzas
entre el Ministerio de Salud y el poderío económico, técnico y político de
las multinacionales (que se lucran de la presión tecnológica con precios
exorbitantes, que no siempre implican genuinos avances terapéuticos). Ese
imaginario colectivo, favorable a los esfuerzos evidentes que adelanta el
equipo técnico del Ministerio en materia de regulación de precios,
constituye un capital social que debe
preservarse con medidas regulatorias más contundentes.
5.
Los desafíos que plantean la Ley Estatutaria, la PFN y el Artículo 72 de la Ley del
Plan Nacional de Desarrollo
Además de todo lo anterior, la renaciente CNPMyDM tiene obligaciones que se
desprenden de la Ley 1751 de 2015 o Estatutaria de
Salud, que en relación con los medicamentos, es taxativa cuando en el Artículo 5° relativo a Obligaciones del Estado, en el inciso j) ordena:
“Intervenir el mercado de medicamentos, dispositivos médicos e insumos en salud con el fin de optimizar su utilización, evitar las inequidades en el acceso, asegurar la calidad de los mismos o en general cuando pueda derivarse una grave afectación de la prestación del
servicio”.
Además el Conpes
social 155 de Política Farmacéutica Nacional, en el Artículo
23 dice: Parágrafo.
“El Gobierno Nacional, por intermedio del Ministerio de Salud y Protección Social, estará a cargo de regular los precios de los medicamentos a nivel nacional para los principios activos. Dichos precios se determinarán con base en comparaciones internacionales. En todo caso no podrán superar el precio internacional de referencia de acuerdo con la metodología que defina el Gobierno
Nacional”. Es decir, plantea que la regulación debe hacerse por
principios activos.
Finalmente, el artículo 72 de la
Ley 1753 de 2015
del Plan Nacional de Desarrollo, dice:
ARTÍCULO 72. Registros sanitarios de medicamentos y dispositivos médicos. La evaluación que realice el Instituto de Evaluación Tecnológica en Salud (IETS) a los medicamentos y dispositivos médicos definidos por el Ministerio de Salud y Protección Social (MSPS) y el precio que este ministerio determine con base en esa evaluación, serán requisitos para la expedición del correspondiente registro sanitario y/o su renovación por parte del Instituto Nacional de Vigilancia de Medicamentos y Alimentos (Invima). El proceso de determinación del precio de que trata este artículo se hará en forma simultánea con el trámite de registro sanitario ante el Invima. Para tal efecto, el MSPS establecerá el procedimiento que incluya los criterios para determinar las tecnologías que estarán sujetas a este mecanismo y los términos para el mismo, los cuales no podrán superar los fijados en la normatividad vigente para la expedición del correspondiente registro sanitario.
Toda
esta normatividad supone un esfuerzo regulatorio de dimensiones
colosales para la renaciente CNPMyDM y es válida la pregunta de si dicha
comisión -y el Ministerio de Salud que ahora está a cargo de la secretaría
técnica- está en condiciones de adelantar un esfuerzo técnico y presupuestal
de esa magnitud. La Academia, las organizaciones de la sociedad civil y los organismos
gremiales que por Ley somos asesores del gobierno, estamos en la obligación de
permanecer vigilantes del cumplimiento de la normatividad
vigente y -como lo ordena la Ley Estatutaria de salud- ejercer nuestra
corresponsabilidad en la defensa de los intereses de la salud pública.
Próximo
número: Declaratoria de interés público de IMATINIB y lo que falta en regulación de precios de medicamentos
Envíe sus aportes y
comentarios a observamed.fmc@gmail.com
o trine con @OBSERVAMED
Sobre
conflictos de interés:
La iniciativa "Elijamos
Sabiamente" de la Federación
Médica Colombiana FMC y el Colegio
Nacional de Químicos Farmacéuticos de Colombia CNQFC, no recibe ninguna retribución monetaria, ni en
especie, de ninguna entidad pública ni privada, que pueda comprometer
la independencia de sus investigaciones e informes.
|