|
Según
publicaciones de prensa este mes de mayo de 2010 el sistema de salud
colombiano estará ilíquido
Modelo colombiano enseña al mundo que liberalización excesiva
de precios de medicamentos tiene efectos nefastos
Dice la FMC que las Resoluciones
1424,
1499,
1662,
1663 y
Circular 03 no lograrán los ahorros prometidos
por MinProtección, porque son un "tratamiento
sintomático" que solo bajará un poco la fiebre. La
inminencia del colapso financiero del sistema de salud -que según
notas de prensa este
mes ya estará ilíquido- exige un "tratamiento
etiológico" que elimine una de las causas más importantes
en el tema de
medicamentos: La liberalización desmedida de precios, originada
en la Circular 04 de 2006
 |
La
Federación Médica Colombiana (FMC) considera que el Decreto
1313 de importaciones paralelas, las Resoluciones 1424,
1499,
1662, 1663
y la Circular 03 de
2010 que
le complementan, no producirán los ahorros
prometidos por el Ministro de la Protección Social.
Dicen los médicos que los anuncios del Ministro -cuando quiso presentar una carta de Abbott como un logro
de la emergencia social, cuando anunció
"éxitos" en negociaciones de Etanercept y
cuando anunció
unas pocas importaciones paralelas como la grán
solución- son una forma mediática de bajar un
poco la fiebre. Es decir, son básicamente tratamientos
parciales y "sintomáticos" que no atacan las
verdaderas causas del problema y por lo tanto no
controlarán el impacto de los medicamentos en
la crisis financiera del sistema de salud. |
|
Según
la FMC, la inminencia del colapso financiero del sistema
de salud -que insistimos, según publicaciones de
prensa, este mes de mayo de 2010 ya estará ilíquido-
exige soluciones estructurales
-"etiológicas"- que eliminen el modelo de
liberalización a ultranza o política de
desrregulación-desinformación que el actual gobierno
implementó en el mercado farmacéutico, con medidas
como la Circular única de 2004 y la Circular 04 de
2006.
En todas sus participaciones públicas la FMC advirtió sobre
los peligros y la magnitud de los sobrecostos en los precios de
los medicamentos y predijo su importancia para la crisis
financiera del sector salud
(Ver
Presentación de la FMC,
Crisis
y 2 Ministros, FMC
en UniAndes, FMC
en Foro ACEMI, FMC
ante Comisiones Séptimas de Senado y Cámara, FMC
en Foro Universidad Nacional).
Hoy, cuando Colombia
parece avanzar
inexorablemente hacia el colapso financiero de su sistema de
salud, la FMC insiste en que las recientes medidas del gobierno
no son suficientes (Ver BIS-BCM#17,
BIS-BCM#18
y
BIS-BCM#19)
y que es absolutamente necesario adoptar medidas más
estructurales.
|
1. Inconsistencias de la
lista de medicamentos para importaciones paralelas de las
Resoluciones 1424
y 1499
muestran debilidades técnicas que inutilizan la norma
1.1. Inconsistencias SIN
impacto económico:
-
Inclusión
de productos genéricos y "genéricos de marca"
que tienen registro sanitario para "fabricar y
vender" de laboratorios nacionales, es decir son de
fabricación local
Ejemplo: Armol 70mg, Fixopan 70mg y
los Alendronatos genéricos de 70mg de MK-Tecnoquímicas,
Genfar, American Generics y La Santé. Otro ej.: Atorlip
20mg, Atorsyn 20mg, Axo 10 y 40mg y las Atorvastatinas genéricas
de American Generics, Genfar y Winthrop.
Estos casos concretos fueron
corregidos en la RM 1499.
-
Inclusión
de productos considerados "huérfanos" o
"vitales no disponibles" que ya son impórtados
por multiples instituciones
Ejemplo: Agalsidasa beta
(Fabrazyme® 35 mg de Genzyme) que tiene 19 importadores
autorizados en su registro sanitario.
Este tipo de errores NO se corrigió en
la RM 1499.
-
Inclusión
de errores en nombres comerciales o principios activos
Ejemplo: "Leoprostin" como principio activo cuando
en realidad se trata de otro nombre comercial del Acetato de
Leuprolida que comienza la lista con nombre comercial
Eligard®.
Este caso se corrigió en la RM 1499,
pero quedan otros, por ejemplo:
"Sandostatina" (No.126 de la Resolución 1499)
aparece como principio activo de
OCTREOSCAN (CUM 200475-01), cuyo verdadero principio activo
es PENTETREOTIDO. "Sandostatina" es el nombre comercial de OCTREOTIDA.
1.2. Inconsistencias CON
impacto económico:
-
Exclusiones absolutas:
Casos de
medicamentos de alto
impacto en la crisis financiera del sector salud que
simplemente se omitieron en la lista de la Resolución 1424 (ver
la tabla
Top 20 de medicamentos de alto impacto elaborada por el
Observatorio del Medicamento de la Federación Médica
Colombiana donde el número de los productos incluidos
aparece resaltado en azul). Ejemplos:
- Imatinib (Glivec® de Novartis),
- Factor VIII coagulante anti-inhibidor (Feiba® de Baxter),
- Interferon Beta 1A (Avonex® de Abbott) y
- Octreotida (Sandostatina® Lar de Novartis).
Estos
casos se corrigieron parcialmente en la Resolución 1499:
- Imatinib (Glivec® de Novartis),
se
incluyó con CUM
19939440-01 que en 2008
reportó ventas en "0" por todos los canales. NO
se incluyó CUM
19939440-04 que reportó ventas por Col$ 8,934,208,890 y
GLIVEC 400 mg (CUM 19939438-01) que reportó ventas por Col$
31,462,886,600.-
- Factor
VIII coagulante anti-inhibidor (Feiba® de Baxter),
se incluyó
- Interferon
Beta 1A (Avonex® de Abbott) se
incluyó CUM 19977936-01 que en 2008 reportó ventas por Col$
2,441,469,380. NO se incluyó CUM 228018-01 que reportó
ventas por Col$ 11,719,763,194.
- Octreotida
(Sandostatina® Lar de Novartis) No se incluyó,
pese a que en 2008 reportó ventas
por Col$ 13.424.926.748.
-
Exclusiones relativas:
Casos de inclusión incompleta de
medicamentos de alto impacto en
la crisis financiera del sector salud, básicamente
por omisión de CUMs.
- Adalimumab 40 mg (Humira® de Abbott). Se incluyó solo con CUM 19939766-01 que según SISMED 2008
vendió Col$
30,056,999.- No se incluyó CUM 19939766-02 que vendió
Col$ 51,583,064,671.
- Bevacizumab (Avastin® de Roche). Se incluyó solo
con CUM 19956000-01 (ventas Col$ 10,495,843,565.-). No se
incluyó CUM 19956001-01 que reportó ventas por Col$
7,384,799,605.
- Octreotida (Octride de Chalver). Se incluyó CUM 19928405-01
que reportó ventas por Col$ 491,113,182. NO se incluyó ningún
CUM de Sandostatina® Lar (Octreotida de Novartis) que
reportó ventas por Col$ 13.424.926.748.-
Estos
casos se corrigieron parcialmente en la Resolución 1499,
pero persisten casos de mayor importancia para el sistema
como:
- Rituximab (MABTHERA® de Roche). Se incluyó con
CUM 226777-01 que en 2008 reportó ventas por Col$
11,267,224,079. NO se incluyó CUM 226777-02 (hoy CUM
20010363-01) que
reportó ventas por Col$ 60,831,315,038.-
- Imatinib (GLIVEC® de Novartis). Se incluyó con
CUM 19939440-01 que en 2008 reportó "0" en ventas
por canales comerciales e institucionales del laboratorio y
mayoristas. NO se incluyó CUM 19939440-04 que
reportó ventas por Col$ 8,934,208,890 ni GLIVEC 400 mg (CUM
19939438-01) que reportó ventas por Col$ 31,462,886,600.-
- Se incluyó PENTAGLOBIN 10 mL (CUM 43787-01) que en
2008 reportó Ventas por Col$ 1,067,335,906.- y PENTAGLOBIN
50 mL (CUM 43789-01) que reportó Col$ 763,401,353.-
pero NO se incluyó PENTAGLOBIN 100 mL (CUM 43790-01)
que reportó ventas por Col$ 4,122,034,002.-
- Se incluyeron las formas sólidas de KEPPRA, pero NO
se incluyó KEPPRA 100 mg / 5 mL (CUM 19975838-04)
que reportó ventas por Col$ 1,161,850,593.-
- Se incluyeron los genéricos de OXALIPLATINO
50 mg y 100 mg de ROPSOHN (que no son los más costosos),
pero NO se incluyeron otros genéricos de BAXTER, BIOPAS,
SUMIMED, ni las marcas secundarias OXERIN, ENTIA, O-PLAT,
OXERIN, ni el original ELOXATIN, que son de mayor impacto
financiero para el sistema.
- Se incluyó TOBRADEX Suspensión Oftálmica (CUM
33744-01) con ventas reportadas en 2008 por Col$
1,102,604,867, pero NO se incluyó TOBRADEX Unguento Oftálmico
(CUM 34283-01) con ventas reportadas de Col$ 1,048,852,574.
- Se incluyeron RISPERDAL 2 mg CUM 49091-01, 3 mg
(CUM 49092-01), RISPERDAL QUICKLET 0,5 mg CUM 19936267-02, 2
mg (CUM 19936269-02) y RISPERIDAL CONSTA 25 mg, pero NO se
incluyeron RISPERDAL 1 mg (CUM 49090-01) que reportó ventas
por Col$ 1,104,313,034, ni RISPERDAL SOLUCION ORAL (CUM
50888-02) que reportó ventas por Col$ 1,402,081,812.
|
|

Desde el año 2007 la Federación Médica Colombiana
advirtió que la desregulación de precios de
medicamentos precipitaría la crisis financiera del
sistema de salud
Ver
Presentación de la FMC
|
|
FMC
publica página de seguimiento cronológico a la reforma
de la salud en esta etapa post-emergencia social
La Federación
Médica Colombiana publicó una página de seguimiento
documental cronológico al período de emergencia
social, que culminó con la declatoria de
inexequibilidad (click
aquí para ver). Hoy, cuando pasamos a una etapa de
rectificaciones en las políticas públicas de salud
para evitar el colapso final del sistema, la FMC continúa
el registro cronológico
de los documentos, análisis, pronunciamientos, noticias
y opiniones que se produzcan en este momento histórico.
Click
aquí para ver cronología
actualizada.
Esta
semana registramos:
__________
11may2010
Resolución
MPS 1663 de 2010 incluye otros 8 productos en lista de
importaciones paralelas
El Ministerio de la Protección Social expidió la
Resolución 1663 de 2010 que incluye otros 8 productos a
la lista de medicamentos para importaciones paralelas
(Decreto 1313). Se trata de Prevenar®, Sandostatin®,
Adalat®, Betaloc®, Rotarix®, Erbitux®, Ensure® y
Pediasure®. Ver NotaMPS,
PDFenMPS,
PDFenObservamed.
__________
11may2010
Resolución
MPS 1662 de 2010 excluye 10 medicamentos de Productos
Roche S.A. de lista de importaciones paralelas
El Ministerio de la Protección Social expidió la
Resolución 1662 de 2010 que excluye 10 medicamentos de
Productos Roche S.A. de la lista de medicamentos para
importaciones paralelas del Decreto 1313. Se trata de
Avastin®, Pulmozyme®, Neupogen®, Cymevene®, Pegasys®
de 135 y 180 mcg/0,5 mL, Cellcept® de 250 y 500 mg,
Mabthera® y Herceptin®. Ver NotaMPS,
PDFenMPS,
PDFenObservamed.
__________
09may2010
El
estado debe proteger los derechos de los pacientes y
además defenderse del mercadeo ilegal y los abusos de
posición dominante
Reflexiones post-emergencia social:
1. El deber de proteger a los consumidores de
medicamentos, pero también defender el erario público.
2. Mercadeo ilegal. 3. Abusos de posición dominante. El
caso colombiano. FMC publica página de seguimiento
cronológico a la reforma de la salud en esta etapa
post-emergencia social. Ver BIS-BCM#19/2010.
Ver Página
de seguimiento VACELAPSS-FMC.
|
|
|
2.
La Resolución
1662 que EXCLUYE de la lista de importaciones paralelas 10
productos importantes de Laboratorios Roche, pretende mostrarse
como un acierto y es probable que se trate de un error costoso
Según
la Resolución
1662 de 11 de mayo de 2010, se EXCLUYEN 10 medicamentos de la lista de
importaciones paralelas del Decreto 1313, después que Roche
ofreciera descuentos "importantes" con los
productos Avastin®, Pulmozyme®, Neupogen®, Cymevene®,
Pegasys® de 135 y 180 mcg/0,5 mL, Cellcept® de 250 y 500 mg,
Mabthera® y Herceptin®. Veamos la importancia de estos
productos para el sistema de salud:
-
MABTHERA® 500 mg/50 mL
(RITUXIMAB, CUM 226777-02, hoy CUM 20010363-01) según
SISMED 2008 reportó ventas de Col$ 60,831,315,038, por 8,600
ampollas, a casi Col$ 7.000.000 cada una. La Resolución no menciona MABTHERA 100 mg/10 mL
(CUM 226777-01) que reportó ventas por Col$ 11,267,224,079. El
RITUXIMAB es un medicamento biotecnológico que está
aprobado como coadyuvante en el tratamiento de pacientes con
Linfoma No Hodgkin de células beta indoloro y en el
tratamiento de Artritis Reumatoidea en asociación con
Metotrexate.
-
HERCEPTIN® 440 mg
(TRASTUZUMAB, CUM 19903070-01) en 2008 reportó ventas
de Col$ 35,428,470,001, por 4,451 ampollas, a casi Col$
8.000.000 cada una. El TRASTUZUMAB es un medicamento
biotecnológico que está aprobado para el tratamiento del
Cáncer de Mama Metastásico.
-
CELLCEPT® 250 mg
(MICOFENOLATO DE MOFETILO, CUM 204751-02) en 2008
reportó ventas de Col$ 2,059,130,852, por 3,748 cajas x 100
cápsulas a casi Col$ 500.000 la caja y
-
CELLCEPT®
500 mg (MICOFENOLATO DE MOFETILO, CUM 216049-03) en
2008 reportó ventas de Col$ 24,413,824,203, por 46,032
cajas x 50 cápsulas a casi Col$ 540.000 la caja. El MICOFENOLATO DE MOFETILO
está indicado para la profilaxis y tratamiento del rechazo
de órganos en pacientes sometidos a trasplante.
-
AVASTIN 100 mg / 4 mL
(BEVACIZUMAB, CUM 19956000-01) en 2008 reportó
ventas de Col$ 10,495,843,565, por 8,335 ampollas, a casi
Col$ 1.260.000 cada una. La Resolución no menciona AVASTIN 400 mg / 16 mL
(CUM 19956001-01) que reportó ventas por Col$ 7,384,799,605.
El BEVACIZUMAB es un medicamento biotecnológico que está
aprobado para el tratamiento del Carcinoma Metastásico de
Colon o Recto.
-
PEGASYS 135 mcg / 0.5 mL
(PEGINTERFERON ALFA - 2A, CUM 19932792-01) en 2008
reportó ventas de Col$ 453,290,362, por 557 ampollas, a
casi Col$ 815,000 cada una y
-
PEGASYS
180 mcg / 0.5 mL (PEGINTERFERON ALFA - 2A, CUM 19932793-01)
2008 reportó ventas de Col$ 5,984,952,148, por 6,665
ampollas, a casi Col$ 900.000 cada una. El PEGINTERFERON ALFA - 2A
está aprobado para el tratamiento de la Hepatitis Crónica
C.
-
PULMOZYME 1 mg / mL
(DORNASE ALFA, CUM 200666-01) en 2008 reportó ventas de Col$
6,322,471,136, por 7,823 cajas x 6 ampollas de solución
para nebulizar, a casi Col$ 810.000 cada caja. El DORNASE ALFA,
está aprobado para mejorar la función pulmonar de
pacientes con Fibrosis Quística.
-
NEUPOGEN 300 mcg / mL
(FILGRASTIM, CUM 46041-01) en 2008 reportó ventas de
Col$ 1,626,722,072, por 1,384 cajas x 5 ampollas, a casi Col$
1,160.000 cada caja. La Resolución no menciona NEUPOGEN 300 MUI / 0.5 mL
(CUM 19906434-01) que reportó ventas de Col$ 2,975,830,717 por
13,131 ampollas, a casi Col$ 232,247 cada una. El FILGRASTIM
está aprobado como Coadyuvante en el tratamiento de la
neutropenia, en pacientes sometidos a quimioterapia
antineoplásica.
-
CYMEVENE 500 mg
(GANCICLOVIR, CUM 58875-01) en 2008 reportó ventas de Col$ 1,054,845,184, por 5,906
ampollas, a casi Col$ 180.000 cada una. El GANCICLOVIR
está aprobado para el tratamiento de la Retinitis por
Citomegalovirus (CMV) en pacientes inmunocomprometidos.
El
Ministro Palacio pretendió mostrar este rápido arreglo con Roche como
una negociación exitosa que producirá un "ahorro"
de 40.000 millones anuales, pero ¿se trata realmente de una
negociación exitosa o de un costoso "reversazo" en el tema de importaciones
paralelas?. Para responder esta
pregunta, sumemos los datos de ventas reportadas del año 2008
de estos productos (según el párrafo anterior) y veremos que
alcanza los 150.000 millones. Frente a este total, el ahorro de
40.000 millones del Ministro equivale a un descuento cercano
al 27% (si tomamos en cuenta que el Ministro negoció con
datos de 2009 -lógicamente superiores a los del año 2008- los
40.000 millones equivalen a un porcentaje menor). Y ¿es exitosa
una negociación que logra un 25% de descuento con estos
productos de Roche? Si los sobreprecios de estos productos en Colombia
están realmente entre el 20 y el 30%, el Ministro tendría la
razón. Pero, si -como
sugieren estudios muy serios y la carta del Cardenal Rubiano y
organizaciones de la sociedad civil al Presidente de la
República- los sobreprecios de dichos productos son mucho
mayores (y estos descuentos resultan demasiado pequeños),
entonces el Ministro se habría equivocado otra vez, con los
consiguientes perjuicios económicos para las
maltrechas finanzas del sistema de salud.
3.
La
Resolución 1663 INCLUYE 8 productos (que equivalen a 39
CUMs o más) en la lista de
importaciones paralelas. Puede ser importante si los
laboratorios no interponen recursos por inexactitud en los
nombres
Según
la Resolución
1663 del mismo 11 de mayo de 2010, se INCLUYEN en la lista
de medicamentos para importaciones paralelas del Decreto 1313, las
marcas comerciales Prevenar®, Sandostatin®, Adalat®, Betaloc®,
Rotarix®, Erbitux®, Ensure® y Pediasure®. Veamos la
importancia de estos productos para el sistema de salud:
-
PREVENAR®
(Vacuna Antinuemococcica Polivalente de WYETH) CUM 19908709-05,
que según SISMED 2008 vendió Col$ 20,380,206,715.-
-
SANDOSTATIN® (Octreotida de NOVARTIS) que con CUMs 32366-01, 228254-01
y 228256-01 reportó ventas por Col$ 13,424,926,748.-
-
ADALAT® (Nifedipino de BAYER) que con CUMs 227033-02, 41214-06,
41214-05, 41212-06, 227492-06 y 227492-01, reportó ventas por
Col$ 11.749.233.863.-
-
BETALOC® (Metoprolol de ASTRAZENECA) que con CUMs 19927923-01, 200541-06,
34190-04, 34189-07 y 33788-04, reportó ventas por Col$
12.281.827.936.-
-
ROTARIX® (Vacuna Anti Rotavirus de GLAXOSMITHKLINE) CUM 19951123-01
que en 2008 reportó ventas por Col$ 9,089,466,148.-
-
ERBITUX® (Cetuximab de MERCK S.A.) CUM 19953428-01 que en
2008 reportó ventas por Col$ 6,737,032,716.-
-
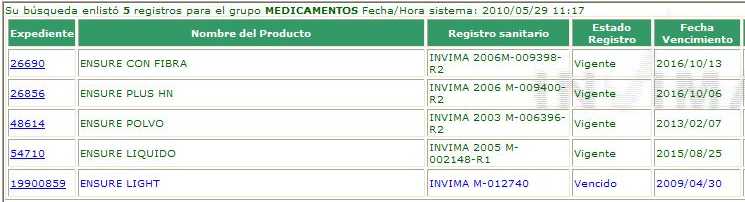
ENSURE® (Fórmula Nutricional Balanceada de ABBOTT) que con
CUMs 54710-01, 48614-03, 48614-01, 54710-02, 54710-03, 26856-01,
26856-02 y 26690-01, reportó ventas por Col$ 40.051.775.893.-
-
PEDIASURE® (Fórmula Nutricional
Pediátrica de ABBOTT) que con CUMs 36650-02, 36650-04, 17702-02,
17702-01, 36650-03, 17702-04 y 17702-03, reportó ventas por
Col$ 18.867.763.567.-
Según publicaciones
de prensa, el ahorro con estos productos puede ser
importante, tomando en cuenta que el año 2009 se habrían
recobrado al FOSYGA cerca de Col$ 120.000 millones. Según
informes de los laboratorios a SISMED 2008 (párrafo anterior), estas 8 marcas y 39 CUMs
reportaron ventas por un total de Col$ 132.582.233.586. Con
cualquiera de estos datos podría considerarse que la
potencialidad de la medida es importante... si los laboratorios no
interponen recursos legales por inexactitud en los nombres.
En
efecto, esta medida puede volverse inocua si Novartis logra tener
registrada la marca "Sandostatin LAR" y puede alegar que la medida afecta
a "Sandostatin", pero no "Sandostatin LAR" (que es mucho más
importante en ventas). Lo mismo podrían hacer Bayer con
"Adalat OROS" y AstraZeneca con "Betaloc
ZOK" que son -de lejos- más importantes que
"Adalat" y "Betaloc". Por su parte Abbott, que
tiene la experiencia de haber seguido vendiendo durante casi 1
año Kaletra® en
Colombia al triple del precio con que lo vendía en Brasil,
Ecuador y Perú (interponiendo recursos
legales contra la Circular 02 de 2009) podría reclamar
legalmente, si tuviese registradas marcas como "Ensure PLUS" o
"con fibra" (independientemente de lo anterior, Abbott
parece manejar una
solución de negocios más eficiente: está volcando su
capacidad promocional a "Ensure FOS" -con Fructo Oligo
Sacáridos- que ya NO aparece en la base de registros sanitarios
de medicamentos del INVIMA. Tampoco aparece la marca
"Ensure" como alimento o
suplemento diatario, pero si se registró como tal, ya no se considera medicamento, no tiene que
reportar precios y no puede ser objeto de importaciones
paralelas).
4.
Finalmente,
la Circular 03 de 2010 no tiene utilidad regulatoria porque la
CNPM no publicó "precios de referencia" (ni siquiera
los precios reportados del último trimestre para
comprobar el "congelamiento" de precios y la limitación
de sus incrementos al IPP)
Tal
como se publicó en el Boletín
BIS-BCM#18,
antes de la Circular 03 de 2010, las Circulares 02
de 2008, la
03, 04
y 05
de 2009, pasaron casi un centenar de productos al régimen
de libertad regulada con la infaltable frase "Mientras
se establece el precio de referencia de los medicamentos aquí
señalados, se aplicará lo establecido en el parágrafo tercero
del artículo 9° de la Circular No. 04 de 2006".
Sinembargo, en ninguno de estos casos la CNPM publicó por lo
menos un "precio de referencia". Peor aún, ni
siquiera publicó los precios "promedio del trimestre
anterior" que el artículo 9° de la Circular No. 04 de
2006 establece como base para comprobar que los incrementos no
sobrepasen el Indice de Precios al Productos (IPP).
Dice
la FMC:
- Que en casi 4 años de vigencia del actual sistema de
"regulación", la CNPM alcanzó a publicar solo un
precio de referencia para un producto: Kaletra® de Abbott.
- Que para calcular los tiempos y movimientos de la CNPM, basta
recordar que Kaletra® pasó a libertad regulada con la Circular
02 del 1° de diciembre de 2008 y tuvo precio de referencia
con la Circular
02 del 28 de abril de 2009, pero, Abbott
anunció que cumpliría recién el 16 de febrero de 2010.
- Y que la Circular 03 de 2010 incluye un listado de 925
productos en libertad regulada
Por lo tanto, la actual CNPM no alcanzará a publicar precios de
referencia de semejante cantidad de productos antes de que
expire el actual gobierno.
Adicionalmente,
la FMC recuerda que presentó derechos de petición en mayo
2007, agosto
2007, octubre
2008, mayo
2009 y marzo
de 2010 solicitando que la CNPM publique precios reportados
y que en todos los casos la respuesta
fue evasiva y negativa. Por lo tanto, cree tener elementos
de juicio para suponer que la CNPM no publicará ni siquiera los
precios "promedio del trimestre anterior" que sirven
de base para comprobar que los incrementos de precios no
sobrepasen el Indice de Precios al Productor (IPP).
|
|