|
1.
IMATINIB
medicamento antineoplásico de indudable interés para
la salud pública
IMATINIB es el primer medicamento antineoplásico de los
llamados “inhibidores específicos de la enzima
tirosina kinasa” (que actualmente son 28) y que la FDA
considera tratamiento de primera línea para Leucemia
Mieloide Crónica (LMC), pero además se trata de un
recurso terapéutico importante en varios tipos de cáncer.
La
marca pionera de este principio activo en Colombia es GLIVEC® de la
multinacional NOVARTIS PHARMA A.G. en cuyo registro sanitario se
encuentran aprobadas las siguientes indicaciones:
“TRATAMIENTO
DE LOS PACIENTES ADULTOS Y PEDIÁTRICOS CON LEUCEMIA MIELÓGENA CRÓNICA
RECIÉN DIAGNOSTICADA ASOCIADA AL CROMOSOMA FILADELFIA (LMC PH+).
PACIENTES ADULTOS Y PEDIÁTRICOS CON LMC EN CRISIS BLÁSTICA, EN FASE
ACELERADA O EN FASE CRÓNICA TRAS EL FRACASO DE UN TRATAMIENTO CON
INTERFERÓN A. TRATAMIENTO DE LOS PACIENTES ADULTOS Y PEDIÁTRICOS CON
LEUCEMIA LINFOCÍTICA AGUDA RECIÉN DIAGNOSTICADA ASOCIADA AL CROMOSOMA
FILADELFIA (LLA PH+), INTEGRADO EN LA QUIMIOTERAPIA** ADULTOS CON LLA
PH+ RECIDIVANTE O RESISTENTE AL TRATAMIENTO, EN MONOTERAPIA. TRATAMIENTO
DE LOS PACIENTES ADULTOS CON SÍNDROMES MIELODISPLÁSICOS O TRASTORNOS
MIELOPROLIFERATIVOS (SMD/TMP) ASOCIADOS CON REORDENAMIENTOS DEL GEN DEL
RECEPTOR DEL FACTOR DE CRECIMIENTO DERIVADO DE LOS TROMBOCITOS (PDGFR).
TRATAMIENTO DE LOS PACIENTES ADULTOS CON MASTOCITOSIS SISTÉMICA (MS)
SIN LA MUTACIÓN D816V DE C-KIT O CON ESTADO MUTACIONAL DESCONOCIDO DE
C- KIT. TRATAMIENTO DE LOS PACIENTES ADULTOS CON SÍNDROME HIPEREOSINOFÍLICO
(SHE) O LEUCEMIA EOSINOFÍLICA CRÓNICA (LEC). TRATAMIENTO DE LOS
PACIENTES ADULTOS CON TUMORES MALIGNOS DEL ESTROMA GASTROINTESTINAL
(TEGI) DE CARÁCTER IRRESECABLE O METASTÁSICO ASOCIADOS A KIT (CD117),
ES DECIR, CON TEGI KIT+. TRATAMIENTO ADYUVANTE DE LOS PACIENTES ADULTOS
EN LOS QUE SE HA PRACTICADO LA RESECCIÓN DEL TEGI KIT+. TRATAMIENTO DE
LOS PACIENTES ADULTOS CON DERMATOFIBROSARCOMA PROTUBERANS (DFSP) DE CARÁCTER
IRRESECABLE, RECIDIVANTE O METASTÁSICO.”
IMATINIB
tiene una eficacia sin precedentes para el tratamiento de LMC. La mayoría
de los pacientes con enfermedad en estadio temprano logran mejoría
hematológica completa duradera y remisiones citogenéticas completas,
con una toxicidad mínima. Se trata pues de un recurso terapéutico de
indudable interés público.
2.
IMATINIB
caso emblemático de prácticas monopólicas y abusos de posición
dominante
IMATINIB
es una celebridad mundial, no solo por su aporte a la terapéutica. Tal
como se explica en la solicitud de IFARMA, MISION SALUD y CIMUN,
IMATINIB es una celebridad mundial por las acciones radicales de la
multinacional NOVARTIS en defensa de sus intereses comerciales, que se
convirtieron en ejemplo de batallas legales en pro de relaciones monopólicas
con abuso de posición dominante.
El
caso de IMATINIB en LMC es emblemático de los antineoplásicos con
precios demasiado elevados -casi siempre insostenibles- que limitan el
acceso a los fármacos por parte de pacientes que los necesitan y son
una real amenaza para la viabilidad de los sistemas de salud, tal como
puede verse en la nota “120
expertos mundiales alertan del precio de las terapias contra el cáncer”
publicada por El País (España) en abril de 2013.
Tal
como se explica la solicitud de IFARMA, MISION SALUD y CIMUN, en Abril
de 2013 el Tribunal Supremo de la India dictó sentencia rechazando la
solicitud de patente de Glivec o Gleevec. Ahora, los fabricantes de
medicamentos genéricos de ese país pueden fabricar legalmente el
principio activo y se espera que reduzcan el precio del medicamento a
una décima parte. Algo muy distinto de lo que está ocurriendo en
Colombia donde las demandas de NOVARTIS prosperaron al extremo de que el
Consejo de Estado “concedió” la patente que el organismo técnico
competente (SIC) había negado, permitiendo el “matoneo judicial”
que esta multinacional adelanta para erradicar la competencia legalmente
establecida en el país (Anexo N°2 de la solicitud). ¿alguien ignora
los efectos catastróficos que el restablecimiento de este monopolio
tendrá sobre el sistema de salud?.
3.
Alto
impacto de IMATINIB sobre la viabilidad financiera del sistema de salud
Tal
como puede verse en la Tabla N°1 el volumen de ventas de IMATINIB
reportadas a SISMED de los años 2008 a 2014 supera la suma de COP 188.000
millones. De ese total, COP 160.000
millones corresponden al pionero GLIVEC (82%) y COP 28.364
millones (18%) a 10 competidores. Al revisar los reportes de GLIVEC
de los años 2008 a 2011 se aprecia una notoria irregularidad, ya que de
40.413 millones el 2008, baja
a solo 58 millones el 2009,
sube a 16.534 millones el
2010 y vuelve a bajar a 7.387
millones el 2011. Se trata de un subregistro que según el promedio
de 2008-2014 puede estimarse en COP 44.474
millones (2009-2011).
Tabla
N°1: IMATINIB reportes a SISMED de los años 2008 a 2014 en COP
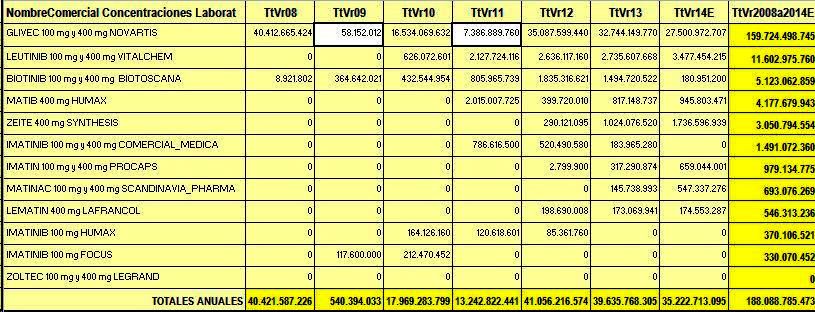
De
acuerdo con estas estimaciones el impacto económico de GLIVEC según
ventas reportadas a SISMED sería de COP 232.563
millones (en lugar de solo COP 188.000 millones).
Pero,
esta suma se refiere a las ventas reportadas por el laboratorio y no
refleja el verdadero impacto de este medicamento sobre la viabilidad
financiera del sistema de salud. Para este fin, es necesario tomar en
cuenta los siguientes aspectos:
3.1.
Alto
impacto de IMATINIB sobre recobros al FOSYGA y la UPC
Al
respecto, vale la pena recordar que la FMC adelanta un largo litigio
para que se hagan públicas las cifras REVISADAS de los recobros con
IMATINIB (y otra veintena de medicamentos de alto impacto). Esta revisión
que debe adelantar el Ministerio de Salud (por acción de tutela de la
FMC y orden de la Sala de Casación Civil de la Corte Suprema) a la
fecha culminó solo para Rituximab y no se hizo aún con IMATINIB. Por
esa circunstancia, nadie en Colombia cuenta con datos definitivos de lo
recobrado con este medicamento y no tenemos más alternativa que estimar
su impacto sobre la sostenibilidad financiera del sistema de salud en
los siguientes términos:
De
acuerdo con la información magnética de recobros entregada a la FMC,
el valor total de recobros con IMATINIB del quinquenio 2006-2010 alcanzó
la suma acumulada de COP 283.544
millones. Al aplicar el promedio anual de ese quinquenio (COP 56.709
millones) a los años 2008 a 2014 (sobre el supuesto de que este
mercado es inelástico y poco responde a ciertas medidas como la
regulación de precios y la inclusión en el POS) puede decirse
–grosso modo- que el impacto sobre las finanzas del sistema de salud
durante esos siete años pudo alcanzar un acumulado de COP 396.962
millones (vía UPC y vía recobros cuando aún no había sido
incluido en el POS, sea con precios no regulados como con precios bien
regulados después).
Por
lo tanto, es posible concluir que GLIVEC está en el grupo de
medicamentos de mayor impacto sobre la sostenibilidad financiera del
sistema de salud y el retorno a las relaciones monopólicas en este
mercado puede ser altamente perjudicial para la misma.
3.2.
Retorno
de este mercado a relaciones monopólicas con abusos de posición
dominante
Como
ya insinuamos líneas arriba, NOVARTIS da muestras inequívocas de
defensa acérrima de sus intereses comerciales a nivel de Colombia y a
nivel mundial, por lo tanto, es de esperar que cuando restablezca
totalmente las relaciones monopólicas en este mercado, puede recurrir a
maniobras de tipo judicial, ampliación de indicaciones y hasta el
desabastecimiento para neutralizar la regulación de precios e inducir
una mayor demanda de este medicamento.
Por
lo expuesto, insistimos en nuestro apoyo a la solicitud de IFARMA,
MISION SALUD y CIMUN, para que IMATINIB (GLIVEC de NOVARTIS) sea
declarado medicamento de interés público y pueda su patente ser
sometida a licencia obligatoria, como la mejor forma de defender el
acceso de los pacientes a este recurso terapéutico, sin afectar
estructuralmente la viabilidad financiera del sistema de salud
colombiano.
Finalizamos
destacando la importancia de este medicamento para el desarrollo del
servicio de salud, ya que se trata de un recurso especial para mitigar
enfermedades y patologías que padecen los pacientes, lo cual tiene
estrecha relación con el interés público y constituye uno de los
fundamentos para que un Estado Social de Derecho cumpla con sus fines.
Cuando
un medicamento esté en el POS en principio se entiende su acceso
universal a toda la población, pero cuando este medicamento del POS,
corresponde al tratamiento de una enfermedad de alto costo como el
IMATINIB, puede afectar gravemente la sostenibilidad financiera de un
sistema que debe garantizar el derecho fundamental a la salud. Por esta
razón la misma ley que garantiza el acceso a dichos medicamentos impone
la obligación al ejecutivo de buscar mejores precios y utilizar las
flexibilidades de la propiedad intelectual.
Aunque
en Colombia no existen antecedentes de otorgamiento de licencias
obligatorias por causas de interés público, puede inferirse de la
normatividad vigente que es posible otorgar licencias obligatorias,
cuando el interés social sea evidente como en este caso, porque como lo
señala el Art. 58 de la Constitución Política, la propiedad privada
está sujeta al interés social.
Teniendo
en cuenta el régimen jurídico sobre la Declaración Ministerial de
Doha, la implementación de dicha figura en países vecinos como Brasil
y Ecuador, el régimen de propiedad intelectual vigente en la Comunidad
Andina de Naciones, la política pública de enfermedades ruinosas o
catastróficas, la Constitución, el Bloque de Constitucionalidad y la
recién sancionada Ley Estatutaria, pedimos declarar de interés público
a IMATINIB (GLIVEC de NOVARTIS) y conceder la licencia obligatoria.
Atentamente,
Dr.
Sergio Isaza Villa Dr. Oscar Andia Salazar
Presidente
Director Observatorio del Medicamento OBSERVAMED
Representante
Legal
Vicepresidente Política Farmacéutica Nacional
Federación
Médica Colombiana Federación Médica Colombiana
|