|
5.3. Tendencia del
uso de Aliskireno en Colombia, según ventas reportadas
De acuerdo con el volumen y la evolución de las
ventas en Colombia, puede verse que este producto viene
más que duplicando sus ventas anualmente en los
últimos períodos. Este uso creciente se acentúa con
las concentraciones y presentaciones mayores. El
Gráfico N°2 muestra que es mayor el consumo de las
concentraciones por 300 mg (¿uso irracional?) y las
presentaciones por 28 Tabletas. Esta apreciación se
confirma con dos ejemplos de capturas de las pantallas
de seguimiento del Sistema VMI-CFN (Vademécum
Med-Informática - Catálogo Farmacéutico Nacional).
Para ver estas imágenes pulse click en la imagen
reducida o el hipervínculo que aparece en la parte
inferio.
Gráfico N°2: Ventas RASILEZ Colombia 2008-2012 Según
Concentración y Presentación
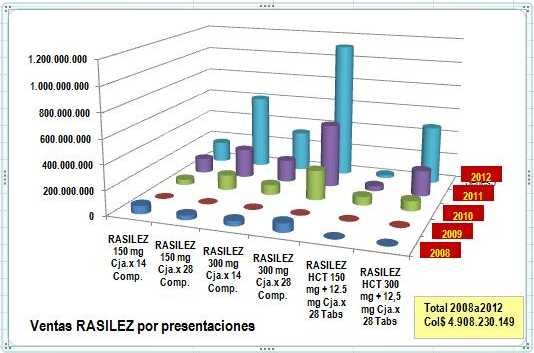
Gráfico N°3 y N°4: Captura de imágenes de
seguimiento del Sistema VMI-CFN


Ver Pantalla
Rasilez 300mg x 28Tabs
| Pantalla
RASILEZ HCT 300mg+12,5mg x 28Tabs
5.4. Precio Máximo de
Venta (PMV) Institucional en Colombia es de 40
a 75% más elevado que en España
Debido al crecimiento exponencial de recobros al
Fondo de Solidaridad y Garantía (FOSYGA) durante el
anterior gobierno, la nueva administración fijó
unos Valores Máximos de Recobro (VMR) que la Circular
04 de 2012 de la Comisión Nacional de Precios de
Medicamentos convirtió en Precios Máximos de Venta
(PMV) Institucional. La Tabla N°1 muestra la siguiente
situación del RASILEZ de 300 mg caja x 28 tabletas: Su
PMV Institucional es de Col$ 168.840.-
El precio en España para el mismo producto, de la misma
concentración, la misma presentación y del mismo
laboratorio es equivalente a Col$ 96.694
(al cambio de Col$ 2.311,15 nominal anual promedio 2012.
El PMV-Institucional de Colombia es 75%
superior). El precio reportado por Novartis al
SISMED es de Col$ 140.493
por Canal Institucional y Col$ 160.012
por Canal Comercial. El precio al público en farmacias
es de Col$ 170.450
.-
| Tabla
N°1: Precio
Máximo Venta (PMV-Inst.) en Colombia vs
Precios en
España y Precios Reportados
y Encuestados |
| N° |
Producto |
PMV(Col$) |
PrSpainEux2.311,15 |
Dif.OMVvsSpain |
PrRep4T2012CI |
PrRep4T2012CC |
PrFarmaciaCol$ |
¿Dónde? |
| 1 |
RASILEZ
300 mg NOVARTIS Cja.x 28 Comp. |
168.840 |
96.694 |
-72.146,32 |
140.493 |
160.012 |
170.450 |
uppe
lrvsd |
| 2 |
RASILEZ
150 mg NOVARTIS Cja.x 28 Comp. |
84.420 |
60.439 |
-23.980,59 |
137.870 |
150.438 |
166.910 |
uppe=
dcssd |
| 3 |
RASILEZ
HCT 300 mg + 12,5 mg Cja.x 28 Tabs |
Sin
PMV |
94.543 |
Sin
PMV |
145.146 |
162.152 |
170.450 |
uppe=lrvsd
upit=dcssd 178.795 |
6. Evaluaciones
Farmacoterapéuticas y Farmacovigilancia
Ver resumen
actualizado de publicaciones JAMA, NEJM, BMJ, AEMPS en
"Weblogs Sanitarios en Español"
6.1.
CIMUN ¿Sabía
usted que?... El
aliskireno (Rasilez®) posee un lugar restringido en la
terapia de la hipertensión.
Interesante
informe de Centro de Información de Medicamentos CIMUN
de la Universidad Nacional. Sección ¿Sabía usted que?...
de abril de 2013
(ver).
Concluye:
"Debido
a que no ha demostrado ventajas son respecto a los otros
antihipertensivos presentes en el mercado, a que no hay
evidencia publicada sobre sus efectos en la
morbimortalidad cardiovascular a largo plazo, a la gran
cantidad de evidencia sobre su eficacia y seguridad que
permanece oculta y a la evidencia emergente sobre los
efectos adversos serios con su uso, el balance
riesgo/beneficio del aliskireno en el tratamiento de la
hipertensión arterial es inadecuado. Por tanto, es
cuestionable tanto ara la permanencia del fármaco en el
mercado como su financiación con recursos públicos
debido a la carencia de instrumentos regulatorios para
limitar su prescripción. En todo caso, el uso del fármaco
debe ser limitado a los casos en los que las otras
opciones terapéuticas no son adecuadas."
"El
caso de aliskireno ilustra adecuadamente los defectos en
la regulación sanitaria de la entrada y permanencia en
el mercado de los productos para la salud. El principio
de precaución debe pesar en éste y en todos los casos
en los que el producto no haya demostrado ventajas clínicamente
relevantes frente a las otras opciones existentes en el
mercado."
Nota:
ALISKIRENO no fue incluido en las evaluaciones técnicas
de la Comisión de Regulación en Salud CRES. No
encontramos registros de otras evaluaciones adelantadas
en Colombia. Algunos ejemplos de evaluaciones de
comunidades españolas pueden verse en:
6.2. COMITÉ DE EVALUACIÓN DE NUEVOS MEDICAMENTOS DE NAVARRA
(2008): ALISKIREN - Rasilez NO SUPONE UN AVANCE TERAPÉUTICO
Ver COMPLETO
Ver ARMI.
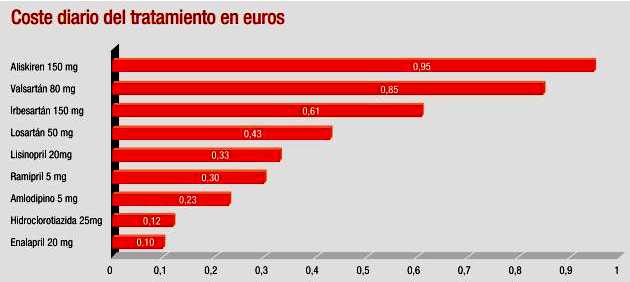
Servicio Navarro de Salud (2009): NO HAY RAZON PARA USARLO.
Ver Gráfico N°5 Ver ARMI.
Gráfico N°5: Precio de ALISKIRENO en España frente a
otras alterntivas terapéuticas
6.3. Notas
terapéuticas Servicio Madrileño de Salud (2009):
NO APORTA VENTAJAS. Ver SaludMadrid
Vol.16 N°1 de 2009. Ver ARMI.
6.4. Evaluación
Servicio de Salud del Gobierno de Islas Baleares
(Dic2008): COMPLETO
ALISKIREN - Rasilez NO supone ningún avance
terapéutico. Ver ARMI.
Conclusiones idénticas en HGC.
6.5.
Evaluación OSAKIDETZA
(2008):
http://bit.ly/15Bf7Ej
Ver ARMI
Calificación: ALISKIREN - Rasilez NO SUPONE UN AVANCE TERAPÉUTICO
Alerta INVIMA:
ALISKIRENO; De acuerdo con la comunicación de la EMA y los estudios revisados por el CHMP de esta agencia, “los productos que contengan Aliskireno no deben usarse en combinación con IECAs o ARAs II en pacientes con diabetes o insuficiencia renal moderada o grave”. De igual manera los efectos adversos no se descartan en pacientes con otras indicaciones y por tal motivo no se recomienda su uso en combinación con IECAs o ARAs II. Según lo anterior:
- Se sugiere a los médicos prescribir medicamentos que contienen aliskireno teniendo en cuenta la alerta de seguridad que emitió la EMA.
- Se sugiere a los médicos no prescribir medicamentos que contienen aliskireno en pacientes con diabetes (tipo1 o tipo 2) o con insuficiencia renal moderada o grave que estén en tratamiento con IECAs o ARAs II.
- Como la combinación de ariskireno con IECAs o ARAs II no se recomienda en pacientes con otras indicaciones, se sugiere a los médicos considerar cuidadosamente el riesgo/beneficio antes de iniciar tratamiento con aliskiren en pacientes que reciben IECAs o ARAs II. Fuente: EMA anuncio de seguridad 17/02/2012.
Ver Documento
INVIMA Ver ARMI
7. Conclusiones:
7.1. De acuerdo a la
evaluaciones del punto 6° y el Gráfico N°5, ALISKIREN
NO SUPONE UN VERDADERO AVANCE TERAPÉUTICO. No muestra
ventajas en cuanto a eficacia o seguridad que
justifiquen su precio bastante superior frente a
alternativas igualmente efectivas y seguras, pero menos
costosas.
7.2. Pese a esa evidencia
internacional, ALISKIRENO entró en Colombia con
protección de datos de prueba del Decreto 2085 o
"Patente Express" que le otorgó protección
equivalente a patente por 5 años (que acaba de vencerse
en marzo de 2013). Puede verse que el INVIMA no es un
organismo especializado en el otorgamiento de patentes y
-como en este caso- puede otorgar protección a
productos que no demuestran suficiente nivel inventivo o
de innovación tecnológica.
7.3. Los precios
de ALISKIRENO en Colombia son significativamente más
elevados que en España (donde precisamente todas las
evaluaciones coinciden en criticar su alto costo). La
Tabla N°1 muestra que este abuso de posición dominante
no es corregido por los Valores Máximos
de Recobro (hoy Precios Máximos de Venta Institucional). Los pacientes en Colombia
adquieren RASILEZ®
de 300 mg x 28
tabletas en la farmacias de Colombia a Col$ 170.450
y el FOSYGA reconoce Col$ 168.840,
cuando en España, el mismo producto, con la misma
concentración y presentación, del mismo laboratorio,
tiene un costo equivalente a Col$ 96.694.
7.4. Pese a que la dosis recomendada de
ALISKIREN es de 150 mg una vez al día, los datos de
ventas muestran claramente que la concentración de 300
mg es la más usada en Colombia, incluso con la
asociación con Hidroclorotiazida. Es posible que este fenómeno se deba a que ALISKIREN fue
posicionado como recurso para casos refractarios que
requieren dosis mayores. Pero es posible también que dicho fenómeno se deba a uso
inadecuado del medicamento. Al respecto, recordemos que
el INVIMA -a diferencia de la FDA, EMA y demás oficinas
reguladoras- no publica la llamada "información
para prescribir" y la difusión de dicha
información queda totalmente en manos de las
farmacéuticas y sus visitadores. El Dr.Sergio Robledo
Riaga, entonces presidente del Colegio Médico de
Cundinamarca y Vicepresidente Financiero de la Federación
Médica Colombiana presentó una acción de tutela para
que el INVIMA publique información para prescribir y de
farmacovigilancia, pero esa acción fue negada en dos
instancias con un argumento insólito que aceptaron los
jueces: Dijo la oficina jurídica del INVIMA que no
existe una norma legal que les obligue.
7.5. Dice la evaluación
del CIMUN que "El
caso de aliskireno ilustra adecuadamente los defectos en
la regulación sanitaria de la entrada y permanencia en
el mercado de los productos para la salud".
Añadimos nosotros que, además ilustra incongruencias y
debilidad institucional en el otorgamiento de
protecciones, en la regulación de precios y en los
sistemas de información para prescribir (hoy en manos
de las farmacéuticas). Queda mucho camino por recorrer
en correctivos estructurales, uso racional del
medicamento y farmacovigilancia.
|