|
Comentarios a
2016: Las metas del gráfico aparecen en extremo concretas y casi
todas prácticamente inalcanzables en los plazos señalados. Felizmente la
realidad va por otras vías y ya se lograron resultados estratégicos de
gran importancia: Los lineamientos básicos de la nueva PFN fueron
introducidos en la Ley del Plan Nacional de Desarrollo
2014-2018 y hacen
parte de la Ley Estatutaria de
Salud. Es decir, la nueva PFN está
evolucionando de una forma muy distinta de su antecesora de 2003.
Existe ya un marco legislativo estructuralmente diferente que puede
permitir avances superiores a los previstos en metas fijadas para los
años 2012 a 2021. Ver Punto
5.
3.
Objetivos de la Política Farmacéutica Nacional Conpes155/12
Objetivo de largo plazo:
Contribuir al mejoramiento del estado de la salud de la población colombiana.
Objetivo central:
Contribuir al logro de los resultados en salud de la población colombiana a través del
acceso equitativo a medicamentos efectivos y la prestación de servicios farmacéuticos de calidad,
bajo el principio de corresponsabilidad de los sectores y agentes que inciden en su cumplimiento.
Objetivos Específicos:
1. Disponer públicamente información técnica, confiable y oportuna sobre acceso, precios,
uso y calidad de medicamentos.
2. Establecer incentivos a la oferta, la innovación, el desarrollo y la producción de
medicamentos estratégicos y promover el desarrollo de una agenda de investigación y
desarrollo para el aprovechamiento del potencial competitivo de la industria farmacéutica
nacional.
3. Definir y disponer las herramientas de regulación que contribuyan a reducir las
distorsiones del mercado farmacéutico y a mejorar la eficiencia en el uso de recursos financieros del Sistema General de Seguridad Social en Salud – SGSSS, en función de los
resultados en salud.
4. Adecuar la oferta y las competencias del recurso humano del sector farmacéutico al
cumplimiento de los objetivos de la PF.
5. Incrementar la eficiencia de la rectoría y del sistema de vigilancia en salud incorporando
el enfoque de gestión de riesgos.
6. Promover la adopción de estándares armonizados, pertinentes y taxativos, focalizados
sobre la garantía de la calidad de medicamentos y de los servicios farmacéuticos.
7. Propiciar el desarrollo de redes de SF articuladas a las redes de servicios de salud y
centradas en la promoción del uso racional de medicamentos.
8. Diseñar programas especiales de acceso a medicamentos de impacto sobre la eficiencia
del SGSSS.
9. Promover el fortalecimiento, coordinación y coherencia en la gestión institucional inter e
intra sectorial para el cumplimiento de los objetivos de la PF, incluido el compromiso con la
sostenibilidad ambiental.
Comentarios a
2016: Como se dijo en el punto 2, se trata de objetivos para 10 años
cuya realización a la fecha parece casi nula, pero los
avances logrados en el marco institucional, aumentan en gran medida su
factibilidad. Si entre los objetivos se hubiesen incluido los puntos de la
Ley Estatutaria, el cumplimiento sería muy alto.
4. Diez
estrategias para cumplir el Plan entre 2012 y 2021
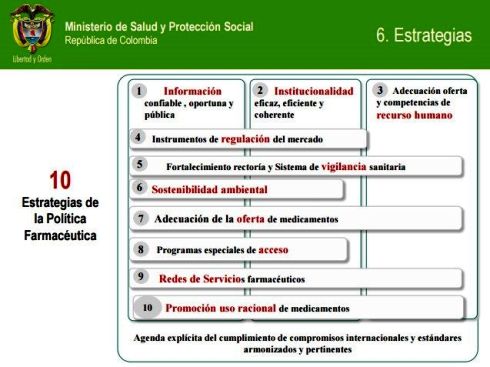
El Plan de Implementación de la PFN se
formuló a diez años (2012 – 2021), a través de diez grandes estrategias con sus actividades y sub-actividades,
que se muestran en el anterior gráfico y se desarrollan a continuación.
1. Información confiable, oportuna y pública sobre acceso, precios, uso y calidad de
medicamentos
Orientada a resolver los problemas de transparencia y asimetría de información de precios,
gasto, consumo, uso y calidad de medicamentos. Se espera poner a disposición del Gobierno, de
las instituciones técnicas y normativas y de los usuarios, información oportuna y confiable para la
toma de decisiones, a través de un único sistema de información.

Las actividades de esta estrategia son las siguientes:
a. Diseño y puesta en operación de un Sistema Nacional de Información Farmacéutica sobre
acceso, uso, calidad y precios. El Sistema propuesto incluirá un módulo farmacéutico en
el Observatorio Nacional de Salud y un módulo de información de seguimiento a la
implementación de la PF.
Este sistema Nacional de información deberá nutrirse de:
Un mecanismo sistemático de valoración del mercado farmacéutico, en convenio con
el DANE, discriminando el gasto público en medicamentos y de bolsillo; información
que, incorporada al SISMED y a las cuentas satélites en salud, permitirá construir un
índice de precios de medicamentos y su análisis por segmentos de mercado (gasto
público y gasto de bolsillo). En el convenio con el DANE se incluirá la realización
periódica de muestreo de precios de medicamentos a lo largo de la cadena de
comercialización. (?)
El diseño de un sistema de información para la orientación de los ciudadanos que
incluya un Vademécum Nacional del POS.
(?)
El diseño e implementación de un sistema único de reporte de la información del gasto
de la industria farmacéutica en promoción, publicidad y de la financiación de
actividades educativas.
(?)
Ver Resolución de transparencia en BisBcm02de2015
El diseño de un sistema de información del INVIMA, que incluya las solicitudes de
registro sanitario, información para prescriptores y usuarios y un Registro Nacional de
Ensayos Clínicos. (?)
El INVIMA sigue sin publicar información para prescribir.
El diseño de un plan de mejoramiento del SISMED que incluya la codificación única
de medicamentos, que facilite la comparación de precios.
Ver
Resolución 3166 de 2015
ARMI
que está en marcha.
2. Institucionalidad eficaz, eficiente y coherente
Con el objetivo de crear las condiciones para asegurar la adecuada articulación,
concurrencia, cooperación y la coherencia institucional, se propone la articulación institucional y
normativa que incida en la definición del plan de beneficios, el diseño de un sistema de
vigilancia y la conformación de una comisión de seguimiento a las metas de política establecidas
en este documento CONPES. Se propone fortalecer la diplomacia en salud y acceso a
medicamentos a través de la promoción de la participación en escenarios internacionales en los
que se discutan temas relativos a salud y acceso a medicamentos, preservando la coherencia con
los principios de PF. Las actividades de esta estrategia son las siguientes:
a. Diseño del Sistema Nacional de Evaluación de Tecnologías en Salud que fortalezca el
desarrollo e intercambio de métodos, información y capacidades de las instituciones
relacionadas (CRES, INVIMA, INS, INC), redes de expertos y universidades a nivel
nacional e instituciones a nivel internacional y que promueva la coherencia de las
decisiones, la transparencia y la legitimidad tanto en la definición de los planes de
beneficio, como en el ajuste de la UPC, las guías de atención y el uso y adherencia de la
prescripción a éstas directrices. IETS:
Comenzó con una conposición distinta y falta ver resultados en defensa
de la sostenibilidad del sistema.
b. Formulación y puesta en operación de un Plan de Vigilancia Tecnológica de innovaciones
farmacéuticas. (?)
c. Desarrollo y gestión de la diplomacia en salud y acceso a medicamentos en coordinación
con los sectores involucrados en el diseño, desarrollo e implementación de la política
farmacéutica, que incluya una agenda explícita y contemple mecanismos para sistematizar
la información sobre los intereses promovidos y las posiciones asumidas por el país en los
temas relativos a salud y acceso a medicamentos que se discutan en el exterior.
(?)
d. Creación de la Comisión de Seguimiento de la Política Farmacéutica CSPF, como
instancia de seguimiento y orientación estratégica de la PF para el monitoreo de las metas
y acciones establecidas. El MSPS ejercerá la secretaría técnica de esta comisión y la
presidencia se ejercerá de manera rotativa entre las entidades que la conforman (MSPS,
MCIT, Ministerio de Relaciones Exteriores, MEN; Colciencias; Ministerio de Ambiente y
Desarrollo Sostenible y DNP). (?)
3. Adecuación de la oferta y las competencias del recurso humano del sector
farmacéutico
Esta estrategia busca promover la adecuación de la oferta y calificación del recurso humano
a los retos y metas de la PF, a través de programas intersectoriales para la promoción de la
profesionalización y especialización en áreas acordes con los retos de desarrollo del sector
farmacéutico clínico-asistencial e industrial. Incluye las siguientes actividades:
a. En coordinación con el DANE, el MSPS deberá diseñar e implementar un Registro de
droguerías y farmacias y servicios farmacéuticos, para promover la dispensación segura y
el uso racional de medicamentos. El Registro deberá proveer un conocimiento preciso
sobre el recurso humano del sector, su distribución geográfica, y la calidad del
funcionamiento de estos establecimientos de manera que pueda soportar el diseño de
redes de servicios y los procesos de especialización, profesionalización y tecnificación.
Adicionalmente, la consolidación de este Registro permitirá la realización de ejercicios
de selección de muestras para encuestas detalladas que sirvan como insumo para la
caracterización del sector. (?)
b. Definición de competencias en farmacia y farmacología, por parte de la Mesa Sectorial de
Servicios a la Salud, para las profesiones y ocupaciones de la salud y otras requeridas en
el sector farmacéutico. Con base en las competencias definidas, el MSPS, en coordinación
con el SENA y el MEN diseñará un plan de actualización y formación continua del
Talento Humano. Adicionalmente se estructurarán proyectos de certificación de
competencias laborales para el reconocimiento de las personas que realizan actividades
relacionadas con farmacia y farmacología, que les permita actuar competitivamente con
los más altos estándares de vigilancia sanitaria. (?)
c. Establecimiento de un plan de actualización y ajuste curricular de los programas de
formación del área de la salud, teniendo como referencia las competencias definidas para
el campo farmacéutico. Este plan deberá articularse al desarrollo del Observatorio Laboral
para la Educación y del Observatorio de Talento Humano en Salud. (?)

4. Instrumentos para la regulación de precios de medicamentos y monitoreo del mercado
Tiene como propósito configurar una caja de herramientas que mejore las capacidades
regulatorias y de vigilancia y detecte y resuelva las distorsiones del mercado. Contempla las
siguientes actividades:
a. Herramientas para la regulación de precios que incluya los métodos para la definición de
precios en aquellos segmentos en donde se requiera, el uso de precios internacionales de
referencia, la promoción de negociaciones centralizadas de precios, la realización de
importaciones y el fortalecimiento de SISMED para un monitoreo estructurado, entre
otros mecanismos. El
tren de la regulación se detuvo. Ver BisBcm43de2015.
b. Fortalecimiento de la capacidad del Grupo Técnico Asesor del Ministerio de Salud y
Protección ante la CNPMDM, para la realización de estudios técnicos que soporten la
toma de decisiones de la CNPMDM.
(?)
c. Identificación de las razones del bajo uso en Colombia de las flexibilidades incluidas en el
sistema de propiedad intelectual y, de ser el caso, desarrollar los marcos regulatorios a los
que haya lugar. (?)
d. Realización de un estudio para determinar si el sistema de propiedad intelectual ha
influido en Colombia sobre los precios de medicamentos y establecer un sistema público
de monitoreo periódico que permita hacer seguimiento a esta información.(?)
5. Fortalecimiento de la rectoría y del sistema de vigilancia con enfoque de gestión de
riesgos
La estrategia concentra las acciones asociadas a promover y asegurar la calidad en la
producción y la efectividad clínica de los medicamentos; se centra en el fortalecimiento del
Ministerio de Salud, INVIMA, de la Superintendencia Nacional de Salud y otras entidades del
sistema de vigilancia en salud, procurando una mejor articulación intra e intersectorial y el
desarrollo de la reglamentación que garantice la calidad de los medicamentos comercializados y a
los servicios farmacéuticos prestados en Colombia. Contempla las siguientes actividades:
a. Consolidación funcional de la Dirección de Medicamentos y de Tecnologías en Salud.
La Dirección establecerá una agenda de reglamentación que resuelva los vacíos
regulatorios, en especial los relacionados con registro y vigilancia de medicamentos
de origen biológicos, estrategia de exigencia de biodisponibilidad y uso fuera de
indicaciones aprobadas, reglamentación de importaciones paralelas y licencias
obligatorias, entre otros. (?)
b. Diseño y operación de un sistema integrado de consulta de la reglamentación
farmacéutica. (?)
c. Formulación y desarrollo del plan nacional de verificación de estándares de calidad de
los servicios farmacéuticos y de los estándares de atención, en cabeza de la
Superintendencia Nacional de Salud. (?)
d. Rediseño del sistema de vigilancia incorporando el enfoque de gestión de riesgos. Para
el efecto se hace necesario:
La adecuación y modernización de los procesos de registro a través de la
configuración de salas expertos de alto perfil, libres de conflictos de interés.
(?)
La incorporación de tecnologías de trazabilidad al mercado farmacéutico.
(?)
El diseño de la estrategia de comunicación e información de riesgos.
(?)
El desarrollo de un programa de cumplimiento integral de las buenas prácticas
en la cadena. (?)
El desarrollo de un programa de vigilancia postcomercialización de medicamentos en el mercado; erradicación de medicamentos falsificados y de
vigilancia y control de la publicidad y promoción farmacéutica y que controle
aquellos productos que sin ser medicamentos buscan ofrecer beneficios terapéuticos.
(?)
El desarrollo de un programa de fármaco-vigilancia que incluya la generación
y difusión de sistemas de alertas, la vigilancia activa de medicamentos de
interés, la vigilancia de usos no autorizados, así como planes de gestión de
riesgo y vigilancia de errores de medicación, además de estrategias de prevención (etiquetas y nombre similares).
(?)
El desarrollo de un plan de certificación y acreditación de la red de
laboratorios de control de calidad; (?)
La configuración y funcionamiento de esquemas de veeduría y control social a
la IVC. (?) Los esquemas de veeduria y control
social funcionan con su propia dinámica

6. Compromiso con la sostenibilidad ambiental y el aprovechamiento de la biodiversidad
Las actividades correspondientes a esta estrategia se articulan a la normatividad vigente de
la gestión post consumo y a los procesos de producción sustentables de medicamentos basados en
el aprovechamiento de la biodiversidad; y se orientan a:
a. Establecer, en cabeza del MSPS, una agenda de trabajo compartida con el MADS,
COLCIENCIAS y MCIT que articule el desarrollo de las metas del Conpes de biodiversidad y de la Política Nacional para la Gestión Integrada de la Biodiversidad y los
Servicios Ecosistémicos y el de PF. (?)
b. El desarrollo conjunto, entre el MSPS y el MADS, de un estudio sobre la situación actual
de gestión de residuos farmacéuticos de origen hospitalario y de manejo de sobrantes de
hogares que reduzca los riesgos de contaminación ambiental y de adulteración de
medicamentos. El estudio deberá contemplar la evaluación a futuro de contaminantes
ambientales derivados de la eliminación y disposición final de residuos farmacéuticos e
incorporar referentes internacionales. (?)
c. Elaborar las normas técnicas para reglamentar un Sello Ambiental Colombiano de
servicios farmacéuticos y de la industria farmacéutica. (?)
d. Diseño y desarrollo, conjunto, entre el MSPS, MSDS e ICA, de una agenda de
investigación sobre el uso de antibióticos de uso veterinario e impacto en la salud humana
y en el medio ambiente. (?)
7. Adecuación de la oferta de medicamentos a las necesidades de salud nacional y regional
En esta estrategia incorpora actividades para el estímulo a la investigación; el desarrollo y
la producción de medicamentos estratégicos; la promoción de la competencia (genéricos) de
medicamentos y; la disponibilidad nacional de medicamentos para enfermedades priorizadas por
el MSPS. La estrategia propone desarrollar las siguientes actividades:
a. Estímulo a la investigación, desarrollo y producción de medicamentos estratégicos,
mediante convocatorias de investigación conjunta entre COLCIENCIAS, MSPS y el
MICT y de programas de estímulo a la competencia del MICT. (?)
Nada visible.
b. Diseño de un programa de desarrollo de productos de base biotecnológica y fitoterapéutica
armonizado con el CONPES de biodiversidad y la Política Nacional para la Gestión Integrada de la Biodiversidad y los Servicios Ecosistémicos.
(?)
c. Fortalecimiento de las capacidades nacionales de investigación clínica mediante el
estímulo al desarrollo de programas y proyectos de investigación farmacoepidemiológica,
contacto y comunicación gubernamental con los grupos de investigación clínica del país,
monitoreo de convocatorias de investigación internacionales y la promoción de la
conformación de redes de investigación nacional e internacional. (?)
Funcionan solo los grupos vinculados al interés de los laboratorios

8. Desarrollo e implementación de programas especiales de acceso a medicamentos
Se propone el desarrollo de modelos que incorporen elementos como la negociación
centralizada de precios; logística moderna; programas de gestión de beneficios de medicamentos:
de alto costo y baja prevalencia, para enfermedades priorizadas, para enfermedades de interés en
salud pública y, de control especial administrados por el Fondo Nacional de Estupefacientes.
Se propone el seguimiento integral de una cohorte de pacientes con una ECNT
seleccionada desde el diagnóstico, la prescripción, la dispensación, el seguimiento
farmacoterapéutico en el marco de un servicio farmacéutico basado en APS y la documentación
de desenlaces en salud, que permita ilustrar el vínculo entre el acceso suficiente y oportuno a la
terapia farmacológica y la calidad en la atención, con los resultados en salud. A este programa se
denominará 100% gestión de beneficios farmacéuticos (100% GBF). (?)
9. Diseño de redes de servicios farmacéuticos
La estrategia se orienta a impulsar elementos necesarios para la cualificación y
mejoramiento de los servicios farmacéuticos en concordancia con los objetivos del SGSSS (Ley
1438 de 2011) y la PF. Incluye las siguientes actividades:
a. Diseño, desarrollo y seguimiento de un programa de acreditación de centros de excelencia
de servicios farmacéuticos especializados por problemas de salud (oncología, artritis
reumatoidea, asma, etc.); grupos poblacionales (pediátricos, geriátricos, etc.); grupos de
medicamentos específicos (opiáceos, medicina nuclear, etc.); entre otros.
(?)
b. Diseño de un programa de incentivos a la habilitación y mejoramiento de la oferta de
servicios farmacéuticos, basados en APS, en zonas periféricas, donde las condiciones del
mercado no promueven su desarrollo. (?)
c. Seguimiento a la gestión e impacto de servicios farmacéuticos articulados a las redes de
prestación de servicios previstas en la Ley 1438 de 2011. (?)
d. Fortalecimiento de los comités técnico-científicos y de los comités de farmacia y
terapéutica de las Instituciones Prestadoras de Servicios de Salud. (?)

10. Promoción del Uso Racional de Medicamentos
Esta estrategia promueve el uso de tecnologías informáticas para el seguimiento de los
resultados en salud asociados al uso de terapias farmacológicas. Incluye las siguientes
actividades:
a. Establecimiento de la prescripción electrónica de medicamentos No POS y de una base
de datos única de pacientes con información sobre desenlaces clínicos. (?)
b. Diseño y desarrollo de un mecanismo de disposición pública de información
farmacéutica, farmacológica y sanitaria administrada por INVIMA. (?)
¿solo piloto?
c. Diseño y desarrollo de una estrategia nacional de gestión del conocimiento y
comunicación soportada en el sistema de información farmacéutica, que incluya
información terapéutica independiente a ser entregada de forma directa a médicos,
farmacéuticos, enfermeras y población. (?) Solo
información por nombre comercial
d. Diseño y seguimiento a la implementación de la estrategia de comunicación de los
resultados de la gestión de vigilancia sanitaria. (?)
e. Plan de fortalecimiento de la regulación y la vigilancia del uso y la resistencia de
antimicrobianos a nivel nacional. (?)
f. Diseño de la estrategia de comunicación y la ejecución de campañas de formación e
información sobre uso adecuado de medicamentos a los profesionales de la salud, la
escuela, la comunidad y el hogar. Esta actividad incluirá información farmacoterapéutica
y sobre uso adecuado de medicamentos. (?)
5. SEGUIMIENTO Y EVALUACIÓN
Se propone realizar un Plan de Acción anualizado para la implementación y el seguimiento
de la PFN por parte de la CSPF, que defina un Sistema de Monitoreo y Evaluación (MYE) que
permita generar información sobre su desempeño y resultados.
1. Metas de Política
Como resultado de la implementación de esta política se busca alcanzar la entrega
suficiente y oportuna al 100% de las personas que hacen uso de los servicios de salud y a los
cuales les son recetados medicamentos, en cualquier región del país. Así mismo, se espera una
reducción sostenida de los precios, en especial para medicamentos priorizados; unido a lo
anterior, se diseñará un índice de precios de medicamentos del cual se espera observar
variaciones menores a las observadas en el Índice de Precios al Consumidor IPC que mide la
inflación global del mercado colombiano.
Se espera que con el mejoramiento de los planes de educación continuada y actualización
de las competencias de recurso humano del sector, así como con el fortalecimiento de los
sistemas de Inspección y Vigilancia y de la institucionalidad, se logre una reducción sistemática
del valor de las reclamaciones de medicamentos No POS.
El uso racional de medicamentos no cuenta con una línea de base para su medición; el
desarrollo del presente documento ha permitido identificar indicadores que permiten hacer
seguimiento a la política farmacéutica pero, dado el estado actual de los sistemas de información,
su cálculo no es posible. Los indicadores identificados son: Razón Precio Medio Internacional /
Precio Medio Nacional de Medicamentos, Razón Uso de Medicamentos Sustituto No POS/ POS,
Razón Uso de Medicamentos Trazadores en Patologías Priorizadas, frente a un Estándar,
Densidad de Redes de Servicios Farmacéuticos, entre otros. Los desarrollos propuestos en
sistemas de información en el marco de esta política (mejoramiento del SISMED, Sistema
Público de Información y Monitoreo de Precios de los Medicamentos, Sistema de Información
Farmacéutica) deben permitir el diseño, cálculo, análisis y seguimiento a los indicadores
identificados. La Tabla que se muestra a continuación presenta algunos de los indicadores de
política que aquí se propone. Pulse
click sobre la imagen para ver detalles.
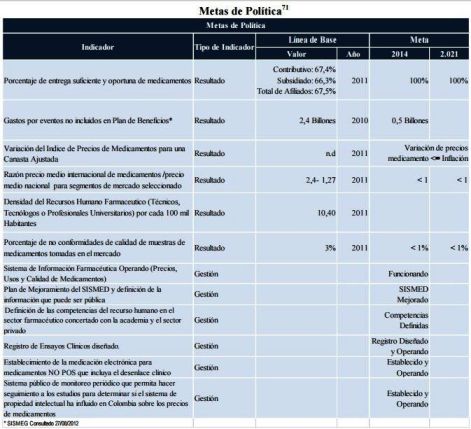
Pulse
click sobre la imagen para ver detalles
|