|
b) Al comenzar la
administración Santos, se fijó el objetivo de controlar ese
fenómeno y adoptó un sistema de regulación basado en "Valores Máximos
de Recobro (VMR). Expidió el Decreto
4474 de 2010 que facultaba a MinSalud para fijar dichos VMR y
con
las Resoluciones 5229
de 2010; 05,
1020,
3026,
3470
y 4316
de 2011, además de la 2569
de 2012, dijeron haber logrado controlar
los sobreprecios de 163 principios activos, equivalentes al 98% de
medicamentos de mayor impacto en los recobros al FOSYGA. El año
2011 los recobros bajaron de Col$ 2 billones. Ver la misma Infografía
N°1.
c) El Decreto 4474 fue demandado ante el Consejo de Estado,
que aceptó la demanda y dejó en el limbo los VMR. Para evitar
un vacío
regulatorio, la CNPMyDM expidió la Circular 04 de 2012
que sumó a los VMR, el 12% de margen de servicio farmacéutico y
los convirtió en nuevos Precios Máximos de Venta (PMV).
d) Ese sistema de regulación,
basado en VMR y su discutible conversión en PMV, fue criticado,
por ser parcial e insuficiente. Parcial, porque afectaba
básicamente a los precios institucionales (y no a los precios
exorbitantes en farmacias). Insuficiente, porque varios de
los precios institucionales, seguían siendo exageradamente más
elevados que -por ejemplo- los precios de referencia en España.
Ver Infografía
N°2.
e) Las diferencias de percepción
eran evidentes. Por ejemplo, la Circular
04 de 2012, fue presentada por los ministerios de
Salud y
Comercio,
como "8.600
nuevos medicamentos a control directo de precios" (enfatizando
un supuesto efecto masivo que estaba en línea con los objetivos
del Documento CONPES de PFN-2012 y las promesas del Presidente
Santos) mientras, organizaciones de la sociedad civil criticaban
lo parcial e insuficiente de la medida y advertían
que la eliminación del margen de 12% de los prestadores (hospitales y clínicas
que deben cubrir gastos del servicio farmacéutico) permitiría
que algunas farmacéuticas, abusen
de su posición dominante y conviertan una parte
variable de ese 12%, en un
aumento de precios, en ocasiones superior al IPC, o la
inflación.
2.
De la
regulación parcial e insuficiente, a la Circular
04/2013: Un paso en la dirección correcta
En el contexto descrito, la
revisión de los PMV fijados por la
Circular 04 de 2013 para 66 productos que reportaron
ventas a SISMED 2012, sugiere un impacto de
aproximadamente $Cols 370.000
millones en disminución de sobrecostos (suponiendo un
año futuro con el mismo número de unidades vendidas el
2012 y los nuevos PMV, si son ratificados). Sin duda, se
trata de un
paso en la dirección correcta, con las primeras 37
moléculas que tenían PMV "insuficiente" o
superior al precio internacional. Ver Detalles
en Tabla N°2.
Para mostrar gráficamente este
hecho, tomamos los 5 productos de mayor impacto del informe
anterior y comparamos el precio promedio reportado por el
laboratorio a Sismed 2009 (precios reales durante el anterior
gobierno) con el PMV de la Circular 04 de 2012 (equivalente a
VMR+12% de servicio farmacéutico) y los PMV del borrador de la
Circular 04 de 2013. Ver Figura N°1.
Figura N°1: Evolución precios
2009-2013 de 5 productos de alto impacto
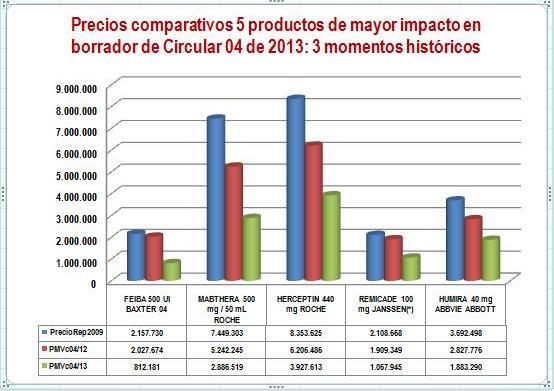 . .
(*) Precio reportado de Remicade corresponde a 2010 por
inconsistencias en reportes Janssen del año 2009.
Otro ejemplo que
permite ver la rectificación que implica el borrador de la
Circular 04 de 2013, puede verse en la Figura N°2:
|
Figura N°2: Comparación precios de
NOVOSEVEN 120 KUI/Vial |
|
Precio de Referencia AEMPS 2012
Precio Máximo de Venta Circular 04 de
2013
Precio Máximo de Venta Circular 04 de 2012
Precio Promedio Canal Institucional Sismed 2011*
Precio Promedio Canal Comercial Sismed 2011*
Precio Mayorista Canal Comercial Sismed 2012
Precio Mayorista Canal Institucional Sismed 2012
|
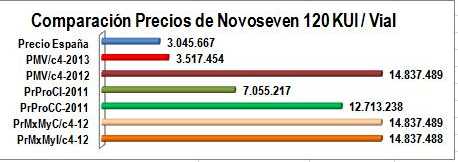 |
a)
Nótese que el nuevo PMV del borrador de Circular 04 de
2013 (columna roja), se aproxima al precio de referencia
español (columna azul) que es similar al de más de 20 países de la Federación
Mundial de Hemofilia,
b) El antiguo VMR de Factor VIIa Recombinante + 12% de
servicio farmacéutico, convertido en PMV de la Circular
04 de 2012 era claramente "insuficiente" o
erróneo (ver
Inciso c del punto 1),
c) Los precios reportados a Sismed 2011 por Amarey
NovaMedical la comercializadora que representaba a Novo
Nordisk con este producto, corresponde a más del doble y
triple de los valores de referencia, en los canales
institucional y comercial (columnas verdes). Nota: Tomamos
reportes del año 2011 porque sus ventas del año 2012 no
fueron reportadas a SISMED,
d) Los precios reportados por los mayoristas a Sismed
2012, por canal comercial e institucional, son equivalentes al PMV de 2012
(columnas color naranja). Nótese que la regulación con
PMV "insuficientes" o errados, induce prácticas perversas.
e) La rectificación en la metodología de fijación de
nuevos PMV, no es suficiente. Debe acompañarse de ajustes
al sistema de seguimiento de la información reportada y
desestímulo de prácticas perversas. |
Estos ejemplos
muestran que el borrador de la Circular 04 de 2013 constituye un
avance regulatorio que debe valorarse con objetividad. El anuncio
ministerial de un ahorro de Col$ 400.000 millones anuales parece
realista, si no se producen cambios importantes en la semana de
revisión y el consumo se incrementa un 10% en unidades. Pero, es claramente insuficiente, porque los recobros siguen rondando
los Col$ 2 billones y el objetivo fijado en el Documento CONPES de
Política Farmacéutica, de reducir esa suma a Col$ 500.000 millones (0,5 billones)
anuales a partir del año 2014, está muy lejos de cumplirse.
Además, el problema
de los sobreprecios exorbitantes en las farmacias persiste sin
mayor modificación, tal como lo demuestran los múltiples testimonios que
se difunden por las redes sociales y todos lo medios de
comunicación. Queda pendiente una colosal tarea de
perfeccionar más PMV de la Circular 04 de 2012 y ampliar la regulación
a los precios exorbitantes en los puntos de venta, que son los que
más afectan el gasto de
bolsillo de los pacientes.
3.
El
reto de perfeccionar más PMV y llevar la
regulación a las farmacias
Asumiendo que la regulación e los medicamentos cuyo mayor
consumidor es el propio sistema comienza a marchar por buen camino
y asumiendo que la fórmula será mejorada y aplicada a los demás
productos de ese grupo, el siguiente paso es llevar la
regulación, a los precios exorbitantes en las farmacias. Sin
duda, esto implica una mayor complejidad regulatoria, que va más allá de la simple fijación de Precios Máximos de Venta
y obliga la adopción de otros mecanismos de regulación directa e
indirecta. Para ver esta complejidad y la
necesidad de otros mecanismos regulatorios, tomamos el ejemplo de
APROVEL (IRBESARTAN de Sanofi-Aventis) que mencionó Juan Gossaín en su último artículo (ver)
junto con sus marcas y genéricos.
Ver Tabla N°1.
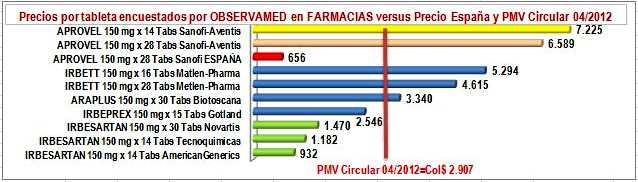
| Tabla N°1: Precios Reportados, Encuestados y Regulados de
IRBESARTAN 150 mg |
|
Nombre
del Producto |
Presentación |
Laboratorio |
PpCI |
PpCC |
PPE |
PMV12 |
Cant |
PpCIu |
PpCCu |
PPEu |
PMVu |
|
APROVEL
150 mg |
Cja.x
28 Tabs |
SANOFI_AVENTIS |
147.179 |
169.333 |
184.505 |
81.396 |
28 |
5.256 |
6.048 |
6.589 |
2.907 |
|
APROVEL
150 mg |
Cja.x
14 Tabs |
SANOFI_AVENTIS |
70.062 |
91.162 |
101.145 |
40.698 |
14 |
5.004 |
6.512 |
7.225 |
2.907 |
|
ARAPLUS
150 mg |
Cja.x
30 Tabs |
BIOTOSCANA |
69.640 |
85.214 |
100.205 |
87.210 |
30 |
2.321 |
2.840 |
3.340 |
2.907 |
|
IRBEPREX
150 mg |
Caja
x 15 Tabs. |
GOTLAND |
8.426 |
14.422 |
38.186 |
43.605 |
15 |
562 |
961 |
2.546 |
2.907 |
|
IRBESARTAN
150 mg |
Cja.x
14 Tabs |
TECNOQUIMICAS |
3.521 |
10.123 |
16.550 |
40.698 |
14 |
252 |
723 |
1.182 |
2.907 |
|
IRBESARTAN
150 mg |
Caja
x 14 Tabs. |
AMERICAN_GENERICS |
3.800 |
8.928 |
13.050 |
40.698 |
14 |
271 |
638 |
932 |
2.907 |
|
IRBESARTAN
150 mg |
Caja
x 30 Tabs. |
NOVARTIS |
24.146 |
43.530 |
44.100 |
87.210 |
30 |
805 |
1.451 |
1.470 |
2.907 |
|
IRBETT
150 mg |
Cja.x
28 Tabs. |
METLEN_PHARMA |
10.982 |
128.050 |
129.232 |
81.396 |
28 |
392 |
4.573 |
4.615 |
2.907 |
|
IRBETT
150 mg |
Cja.x
16Tab |
METLEN_PHARMA |
5.115 |
82.124 |
84.700 |
46.512 |
16 |
320 |
5.133 |
5.294 |
2.907 |
| Precio
APROVEL 150 mg x 28 tabs España = 7,79 Euros x 2.311,15
(TPA2012)=> |
18.374 |
Precio
AEMPS por tableta en Col$=> |
656 |
PpCI
= Precio Promedio Canal Institucional | PpCIu
= Precio Promedio Canal Institucional Unitario
PpCC = Precio Promedio Canal Comercial | PpCCu
= Precio Promedio Canal Comercial Unitario
PPE = Precio Público Encuestado OBSERVAMED en
Farmacias | PPEu = Precio Público
Encuestado OBSERVAMED en Farmacias Unitario
PMV12 = Precio Máximo de Venta fijado por Circular
04 de 2012 | PMVu = Precio Máximo de
Venta fijado por Circular 04 de 2012 Unitario |
Para comenzar el análisis
debemos darle la razón a Juan: El precio de la Agencia
Española de Medicamentos y Dispositivos Médicos (AEMPS) para
APROVEL 150 mg por 28 tabletas, es de 7,79 Euros, que a la tasa de
cambio promedio anual de 2012 (Col$ 2.311,15) equivale a Col$ 18.374,
mientras "en Colombia, con el mismo nombre, hecho por el mismo laboratorio, metido en el mismo empaque, con las mismas 28 pastillas de los mismos 150 miligramos"
(ver)
se vende a Col$ 184.505
(Precio Público Encuestado OBSERVAMED, ligeramente inferior al
precio del artículo Col$ 189.200), un precio diez veces
mayor, que nadie puede justificar desde una perspectiva ética,
científica o económica razonable.
Recordemos luego que, esta
situación es resultado de una política pública de
desregulación de precios o liberalización a ultranza que se
implementó en Colombia desde 2003 y culminó con la Circular 04
de 2006 (ver Infografía
N°1 y lo dicho en el punto 1 de este informe). Los intentos
de regulación de la administración Santos llegaron hasta un
Valor Máximo de Recobro (VMR) de IRBESARTAN de Col$ 17,30
el mg, que por 150 mg y 28 tabletas, daba un sub total de Col$ 72.660
que más el 12 % de servicio farmacéutico daba el total de Col$
81.379 (Resolución 2569 de 30ago12). La Circular 04 de 2012
fijó el Precio Máximo de Venta (PMV) de IRBESARTAN Cápsula, Tableta y/o Comprimido en Col$
19,38/mg,
que por 150 mg y por 28 tabletas equivale a Col$ 81.396
(y Col$ 2.907 por tableta que
aparece en la tabla en letras color marrón).
Ya en la tabla, diferenciemos la
parte izquierda donde en líneas amarillas están 2 presentaciones
de la "marca original o pionera", en líneas azules tres
"marcas secundarias o genéricos de marca" y en líneas
verdes tres genéricos de Irbesartan. En la parte derecha
diferenciemos los precios por tableta, en la columna verde el
precio unitario reportado por los laboratorios en canal institucional, en azul lo
reportado por los laboratorios en canal comercial, en amarillo suave el unitario del
precio encuestado por OBSERVAMED en farmacias y amarillo intenso del PMV unitario
de la Circular 04 de 2012. Luego, veamos los siguientes hechos:
a) No es verdad que esta
administración no haya hecho nada para controlar este caos de
precios. Fijó un PMV "insuficiente" que es 4 veces
superior al precio en España, pero contribuyó a detener el
crecimiento de los recobros (ver Infografía
N°2).
b) En este caso específico, la
marca pionera APROVEL -según sus propios reportes al SISMED- NO respetó
los VMR o PMV fijados por el gobierno y sinembargo no se hizo
pública ninguna sanción. Ver Figura N°3.
Figura
N°3: Precios unitarios reportados IRBESARTAN 150 mg a Sismed 2012
por Canal Institucional
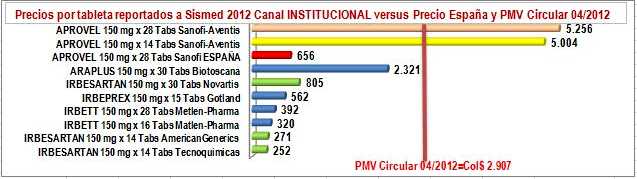
c) Entre los precios reportados por
los laboratorios en el
canal institucional, las marcas secundarias y los genéricos
respetan los PMV. Los genéricos de Tecnoquímicas y Lafrancol son
razonablemente más bajos que el precio público del pionero en España y el genérico
de Novartis es ligeramente superior. Las marcas secundarias de
Gotland y Metlen Pharma tienen un comportamiento similar, pero
Biotoscana se "pega" al precio de referencia y más que
quintuplica el precio de las otras marcas secundarias y genéricos.
Ver Figura N°3.
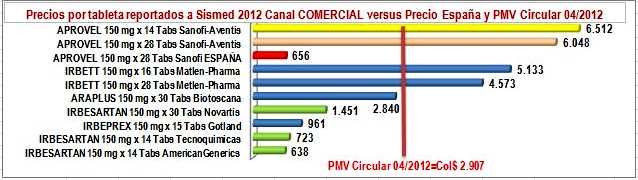
d) Entre los precios reportados por
los laboratorios en el canal comercial -el que afecta las farmacias- solo American
Generics (Lafrancol) reportó un precio inferior al precio
público del pionero en
España. El genérico de Tecnoquímicas y la marca secundaria de
Gotland son ligeramente superiores y el genérico de Novartis más
que duplica ese precio. La marca secundaria de Biotoscana
cuadruplica el precio del pionero en España y la de Metlen Pharma
es 7 veces superior. Ver Figura N°4.
Figura N°4: Precios unitarios
reportados IRBESARTAN 150 mg a Sismed 2012 por Canal Comercial
e) El precio público encuestado
por OBSERVAMED en farmacias, tiene un comportamiento paralelo al
de los precios reportados por canal comercial, con márgenes
razonables, excepto el genérico de Tecnoquímicas que bordea el
margen de 50% y la marca secundaria de Gotland que supera el 100%. Nótese
que, es el laboratorio
el que empuja al alza los precios al público, lo cual contradice
a los opinadores que culpan de los precios perversos a la
intermediación. Ver Figura N°5.
Figura N°5: Precios unitarios
encuestados IRBESARTAN 150 mg por OBSERVAMED en
Farmacias
Los mercados correspondientes a los
demás principios activos mencionados en los artículos de Juan
Gossaín, tienen un comportamiento similar. Tienen una "marca
original o pionera" que es la dominante, varias "marcas
secundarias o genéricos de marca" que pueden tener precios
razonables o imitar las prácticas mercadotécnicas de las marcas
pioneras y
varios genéricos que por lo general tienen precios razonables. A
los principios activos que más afectaron los recobros
-insistimos- ya se les fijaron VMR y PMV (los
Precios Máximos de Venta PMV de la Circular 04 de 2012 equivalen
a los antiguos VMR sumados al 12% de servicio farmacéutico) que
en varios casos resultaron insuficientes (ver Informe
OBSERVAMED sobre 5 años de reportes al SISMED). En esos
casos, de acuerdo con lo visto en las Circulares 03 y 04 de 2013,
se les fijarán nuevos PMV o Precios de Referencia Internacional
(PRI) que seguramente estarán más cerca del precio público en España.
Revisando el ejemplo de la Tabla N°1
y los gráficos 3 a 5 podemos ver que, cuanto más bajos sean los "Precios de
referencia por comparación internacional (PRI)" a fijarse en
próximas Circulares, menor será la tendencia a las prácticas
perversas de las marcas pioneras y secundarias. Sin duda, será mayor el
ahorro del sistema y -si se cumplen las predicciones de MinSalud-
se regularán también los precios perversos al público en las
farmacias. Pero esta parte de la regulación es más compleja y
debe estar acompañada de otras medidas indirectas, que
complementen su efecto benéfico para el sistema y los pacientes.
4.
Otros
mecanismos
de regulación indirecta
Está claro que los nuevos Precios Máximos de Venta (PMV), por
mejorados que sean, no pueden constituirse en el único mecanismo
de regulación. Es necesario recurrir a otros mecanismos, como -por ejemplo- la inclusión de nuevas opciones
en el plan de beneficios del sistema y grandes campañas
informativas sobre el uso correcto de nuevas alternativas.
Estos mecanismos de regulación
indirecta de precios ya fueron empleados por la administración
Santos. No se trató de un cumplimiento pleno de las órdenes de la Sentencia T-760
de 2008 de la Corte Constitucional, pero sí de avances
como la inclusión de Rituximab y Trastuzumab en el actual plan de
beneficios o Plan Obligatorio de Salud (POS).
Algunos medicamentos de alto
consumo en farmacias, varios de
ellos incluidos en los artículos de Juan Gossain, también fueron
incluidos en el POS: Veamos 4 casos que ilustran las ventajas y
limitaciones de estos mecanismos de regulación indirecta.
El caso de Plavix 75 mg
(Clopidogrel de Sanofi-Aventis) caja x 28 tabs, muestra 4 hechos:
(Ver Figura N°6)
a) Los precios en farmacias de Colombia resultan casi 5 veces
superiores al de España
b) El Valor Máximo de Recobro (VMR) antes de su inclusión en el
POS y Precio Máximo de Venta (PMV) de la Circular 04 de 2012 (para indicaciones, terapias y concentraciones no incluidas en el POS) es
"insuficiente". Resulta más de 3 veces superior al precio del mismo Plavix 75 mg caja x 28
tabs en España.
c) El Laboratorio respetó el VMR (luego el PMV) en sus reportes a
Sismed 2012, por Canal Institucional.
d) El precio en farmacias está definido por el precio reportado por el Laboratorio en el canal comercial.
El margen de las farmacias es razonable y el agente que define
el precio exorbitante -casi 5 veces superior al precio en España-
es el laboratorio.
Figura N°6: Precios Reportados,
Encuestados y Regulados de PLAVIX 75 mg y RISPERDAL 20 mg
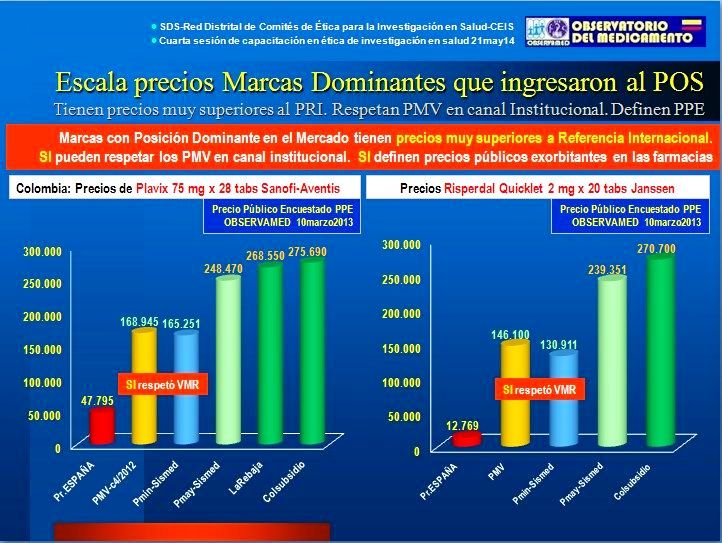
El caso de Risperdal 2 mg
(Risperidona de Janssen) Quicklet x 20 tabletas, muestra los mismos
hechos que el anterior (ver Figura N°6), con la diferencia de un VMR
(luego PMV para concentraciones no incluidas en el POS) que
resulta realmente "insuficiente" por ser más de 11 veces superior al precio
público del mismo producto
en España. El Laboratorio respetó el VMR (luego el PMV) en sus reportes a
Sismed 2012, por Canal Institucional. Y también el precio en farmacias está definido por el precio reportado por el Laboratorio en el canal
comercial y el agente que define
el precio exorbitante -casi 21 veces superior al precio en España-
es el laboratorio.
El caso de Nexium 20 mg
(Esomeprazol de AstraZeneca) por 28 tabletas muestra 4 hechos:
(Ver Figura N°7)
a) El Valor Máximo de Recobro (VMR) antes de su inclusión en el
POS y Precio Máximo de Venta (PMV) de las Circulares 01 y 03 de 2012
que fijan PMV de NEXIUM 20 mg CUM 19915411-05 en Col$ 26.135.- fue
"suficiente". ¡Buen trabajo! pero, por alguna razón
este producto fue excluido de regulación y no aparece en la
Circular 04 de 2012.
b) El Laboratorio NO respetó el PMV en sus reportes a Sismed
2012, por Canal Institucional. El precio reportado por canal comercial
resulta casi 6 veces superior al PMV y no existe ninguna noticia
pública de alguna sanción.
c) El precio en farmacias está definido por el precio reportado
por el Laboratorio en el canal comercial. El margen de las
farmacias es razonable y el agente que define el precio
exorbitante -6 veces superior al precio en España- es el
laboratorio.
Figura N°7: Precios Reportados,
Encuestados y Regulados de NEXIUM 20 mg y LIPITOR 20
mg
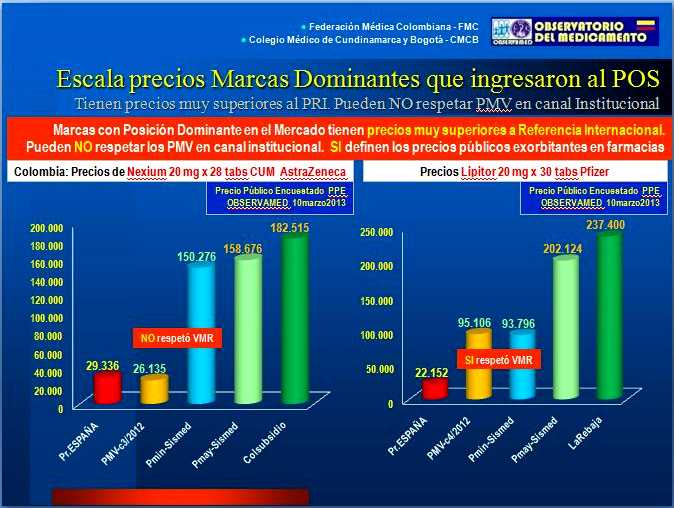
Finalmente, el caso de Lipitor 20 mg
(Atorvastatina de Pfizer) por 30 tabletas, muestra hechos similares
(ver Figura N°7): El VMR (luego PMV para concentraciones no incluidas en el POS)
resulta "insuficiente" por ser 4 veces superior al precio
público del mismo producto en España. El Laboratorio respetó el VMR (luego el PMV) en sus reportes a
Sismed 2012, por canal Institucional. Y -nuevamente- el precio en farmacias está definido por el precio reportado por el Laboratorio en el canal
comercial y el agente que define
el precio exorbitante -10 veces superior al precio en España-
vuelve a ser el laboratorio.
Calcularemos el impacto del nuevo
sistema de regulación en estos 4 productos, cuando aparezcan sus
nuevos PMV "para indicaciones y concentraciones no incluidas
en la plan de beneficios". Por el momento, solo destacamos los
siguiente hechos:
a) Las ventas reportadas de Plavix
en solo 4 años de desregulación y regulacion insuficiente (2008 a
2010 y 2012, porque el 2011 no reportó ventas) alcanzaron la suma
de Col$ 59.985.222.880. Las de Risperdal en 5 años
(2008 a 2012) Col$ 66.995.012.725, Nexium Col$ 63.881.700.842
y Lipitor Col$ 50.162.439.333, para un acumulado de
los 4 productos de Col$ 241.024.375.780 en solo 3 años de
desregulación (2008 a 2010) y 2 de regulación insuficiente (2011
y 2012).
b) Los precios institucionales de los 4 productos intentaron ser
regulados con VMR "insuficiente" y luego PMV para
indicaciones y concentraciones no incluidas en el POS. Uno de
ellos fue inexplicablemente excluido de las listas de regulación.
c) La inclusión de sus principios activos al POS, constituye un
mecanismo de regulación indirecta, no porque efectivamente sirva
para reducir los precios de las marcas pioneras y secundarias,
sino porque direcciona el consumo institucional hacia las opciones
genéricas (pocas EPS gastan sus recursos de UPC en artificios de
marca).
d) El efecto de la inclusión de estos principios activos en el
POS, no se refleja mayormente en las ventas de marcas pioneras,
porque los pacientes no aprovechan esta opción de acceso, tanto
por el imaginario de mala calidad de los genéricos, como por la
escasa o ninguna promoción de las EPS (cuanto menos se consuma,
más mejoran sus estados financieros), la insuficiente difusión
del gobierno y la escasa vigilancia de la Supersalud sobre los
programas de promoción y prevención que deben adelantar las EPS.
e) Los precios reportados por las farmacéuticas en el canal
comercial, confirman que son ellas las principales responsables de
los precios exorbitantes en las farmacias. Esto contradice
claramente lo que afirman sus representantes, en sentido de que la
responsabilidad de los precios perversos, es de la cadena de
intermediación.
En conclusión, está claro que al
primer paso de la Circular 04 de 2013, deben seguirle más y
mejores pasos, para rectificar rápidamente los PMV insuficientes
y complementar el sistema con mecanismos de regulación indirecta
más eficientes. No es justo decir que nada se hizo, pero es
cierto que nada de lo hecho logró corregir el caos en los precios
de las farmacias. Tampoco es cierto que toda la responsabilidad
sea de los responsables de la regulación de precios, porque es
evidente que muchas entidades dentro y fuera del gobierno, no
están cumpliendo adecuadamente su labor.
5.
Desafíos
de la nueva regulación
5.1. David versus Goliat
Después de todo lo anterior, lo cierto es que los nuevos PMV comienzan
afectando a 18 laboratorios que verán reducidas sus
ganancias en una magnitud equivalente al ahorro del sistema
(Ver Detalles
de este cálculo). Las
farmacéuticas que disfrutaron la anterior política de
desregulación, recurrirán a toda su capacidad de argumentación
y "lobby" para minimizar sus pérdidas y complicar la aplicación de la
norma. El pequeño
equipo de expertos de MinSalud, será sometido a un
"bombardeo" de argumentos técnicos, de expertos -bien pagados y mejor dotados- de las farmacéuticas
afectadas por la norma. Se
cuestionarán las fuentes, se extremarán los argumentos y no
faltará hasta quien se declare quebrado y obligado a retirarse del
país.
Se magnificarán algunas inconsistencias
que evidentemente tiene el borrador (ver Columna
de Observaciones en hoja de análisis y la página
de comentarios que publica MinSalud). Es cierto que existen errores de
digitación y un par de ellos influyen en el precio fijado y la
estimación del impacto. Un producto cuyo CUM es del envase por 30
cápsulas, tiene
PMV de una cápsula. Otro par, presenta error en la presentación.
Pero, se trata de casos puntuales cuyo ajuste no debería cambiar
lo central de la norma ni el estimado global de impacto. Falta ver cuál será el resultado final de la confrontación técnica entre
David y Goliat.
5.2. Necesidad de un sistema de
información más robusto
Las inconsistencias mencionadas en el párrafo anterior tienen
relación con el grupo de 70 productos que están activos y tienen
reportes de ventas a SISMED. En relación con los demás productos
incluidos en el borrador, existen muchos inactivos y con errores
poco relevantes. Estos errores (que seguramente servirán para que
los interesados sugieran improvisación y precipitud de la norma)
son transferencia de inconsistencias de las bases de datos del
INVIMA y SISMED, que claramente juegan en contra y deberían
obligar a medidas correctivas urgentes.
En efecto, para mostrar las limitaciones
de la información del SISMED, digamos por ejemplo que: De los
26.961 registros que tiene el archivo del primer trimestre de
2013, solo 8.572 productos tienen datos reportados por los
laboratorios en el canal comercial y solo 5.838 en el canal
institucional. Al intentar un análisis por DCI (Denominación
Común Internacional del Principio Activo) 310 registros presentan
error con principio activo "Ioxitalámico Acido" y 442
registros simplemente no presentan datos de DCI o el código
respectivo. En los archivos publicados, no aparecen datos de
laboratorios o titulares de los registros sanitarios y el campo de
presentación, claramente no está parametrizado.
En la información del SISMED hay
suficientes inconsistencias como para suponer que no existe -o no
funciona- un sistema de validación de datos. Algunos laboratorios
reportan envases por canal comercial y unidosis por canal
institucional, otros, reportan precios y cantidades irracionales,
y otros -incluidas grandes multinacionales- muestran períodos
donde simplemente dejaron de reportar. Claramente, el país
necesita un sistema de información mucho más robusto, que
permita detectar las inconsistencias, sancionar a los infractores
y retroalimentar correctivos al INVIMA. Dada la magnitud de la
tarea, en lugar de un reducido grupo de expertos, tranquilizaría ver algo parecido -por
ejemplo- a las inmensas salas de computación que tienen las EPS
solo para procesar sus recobros al sistema.
5.3. Ajustes a la base de datos
y las funciones del INVIMA
Varios de los errores mencionados en los anteriores párrafos,
provienen de inconsistencias de la propia base de datos de
registros sanitarios del INVIMA (los datos de clasificación del
principio activo o DCI, errados o
inexistentes, tienen ese origen). Pero las deficiencias del
INVIMA van
mucho más allá y tienen efectos más generales y a largo plazo:
- El
INVIMA no publica la "información para prescribir" que
publican otras agencias como la FDA, EMA, etc., por lo tanto es su
responsabilidad que dicha "información para prescribir"
esté capturada por las farmacéuticas y llegue a los médicos con
adecuaciones de fondo y forma que inducen al uso de marcas
comerciales de precios perversos. El INVIMA tampoco publica suficiente información de
farmacovigilancia y no desarrolla campañas educativas entre los
profesionales de la salud, por lo tanto, es también responsable
de la persistencia de los imaginarios de mala calidad de los
medicamentos genéricos, inexistencia de controles, e incluso
aquel absurdo de que en Colombia todavía hay "laboratorios
de garaje", cuando las exigencias de Buenas Prácticas de
Manufactura (BPM)
llevan más de una década de
implementación total.
- El INVIMA no adelanta campañas
educativas para los pacientes y ni siquiera se defiende
adecuadamente de las acusaciones de algunos representantes de las
farmacéuticas, que salen a cuestionar su trabajo y la calidad de
los genéricos en Colombia sin mostrar el debido respaldo
probatorio de sus afirmaciones. Dichas acusaciones, refuerzan el
imaginario perverso -tan difundido entre algunos pacientes- de una
supuesta mejor calidad de las "marcas". Y ese imaginario
perverso, es fuente de millonarias ganancias, no solo para las
farmacéuticas multinacionales, sino para algunas nacionales (y
hasta algunas cadenas de droguerías con "marcas
propias") que cobran precios elevados, en ocasiones tan
exorbitantes como los "pioneros", solo por agregar un
nombre de fantasía o "marca secundaria" a un producto
básicamente genérico.
Es evidente un fortalecimiento
reciente del INVIMA con inocultable apoyo de entidades
norteamericanas, pero, al parecer, más para adecuar el país a las
exigencias de los TLC, antes que para actividades en defensa de
los intereses de la salud pública.
5.4. Que la Superintendencia de
Industria y Comercio y la Supersalud cumplan su labor
La Superintendencia de Industria y Comercio (SIC) en su
página web (ver)
dice estar facultada para iniciar investigaciones por violación del régimen de control de precios de medicamentos (artículo 34 de Circular 4 de 2006 y artículos 10, 11 y 12 del Decreto 2876 de 1984, Artículo 132 de la Ley 1438 de 19 enero de 2011),
pero en la práctica, su accionar en el campo de la salud se
limitó a sancionar algunos casos de publicidad engañosa. Sobre la barbarie de abusos con precios de
medicamentos, puede decirse que el balance es de una inactividad casi
total.
Y la Supersalud es directamente
responsable de la vigilancia de las actividades de promoción y
prevención que deben adelantar las EPS y el sistema en su
conjunto. Si esta función se cumpliera mejor, muchos más
pacientes estarían mejor informados y accederían más a los
servicios a que tienen derecho. Tendríamos menos víctimas de la
información asimétrica y los imaginarios perversos que solo
sirven a los intereses comerciales de actores que se benefician
con esta situación.
5.5. Necesidad de una visión
macroeconómica
Atrapados como estamos aún en la contención de prácticas perversas que otros países ya superaron, no logramos incluir aún en el debate soluciones más estructurales como los
mecanismos de compras centralizadas, una visión de largo plazo en el manejo de los temas de propiedad intelectual y el desarrollo de una política industrial dirigida a generar mecanismos alternativos de autoabastecimiento.
La falta de esta perspectiva macro está implícita en las críticas que en nombre de la sociedad civil hicimos al entonces proyecto de Circular 03 de 2013, específicamente sobre la eliminación del régimen de libertad regulada y la "dilución" de la función central que el régimen de control directo tiene en el manejo de las tendencias monopólicas de gran calado, como es el caso de los medicamentos Biotecnológicos.
En cuanto a los mecanismos de compras centralizadas, quedó históricamente demostrado que el modelo de intermediación con EPS, también ha sido perjudicial en este campo, porque no ha permitido desarrollar un sistema de este tipo, que hace parte estructural de la solución en otros países.
Y si en Colombia no fue posible desarrollar un modelo de compras centralizadas ¿qué podemos decir de una política pública dirigida al desarrollo de la industria nacional y el aseguramiento del autoabastecimiento?. La falta de discusión acerca de este tipo de políticas pareciera sugerir que la única política viable es la del libre comercio y la dependencia de productores y mercados internacionales. Esta falta de alternativas es particularmente preocupante en frente a la toma del mercado de genéricos por parte de multinacionales como Sanofi-Aventis que luego de comprar a una pequeña fabricante de genéricos en Antioquia, acaba de adquirir Genfar, la firma más emblemática del mercado de genéricos en el país. Si a esto sumamos que una firma chilena acaba de adquirir Lafrancol, que Procaps parece poco interesada en potenciar su línea de genéricos y que Tecnoquímicas también está profundizando su interés en marcas secundarias, el panorama para los medicamentos genéricos de la industria nacional y el autoabastecimiento es claramente sombrío.
Para terminar, digamos que este informe no pretende ser un estudio exhaustivo de la realidad colombiana en este campo. Se trata solo de un llamado a la moderación de posiciones retóricas, a una mejor contextualización de las medidas en marcha y a concentrar esfuerzos en la profundización de las medidas que efectivamente defiendan los intereses de la salud pública.
Oscar
Andia Salazar
Director
Observatorio del Medicamento - OBSERVAMED
Federación Médica Colombiana |
Tatiana
Andia Rey
Investigadora Asociada
Observatorio del Medicamento - OBSERVAMED
Federación Médica Colombiana |
Referencia a datos de OBSERVAMED en
medios:
01ago13: Precios de medicamentos: ¿cómo se reparte la torta?
César Rodríguez y Tatiana Andia en La Silla Vacia. Datos Obs.
29jul13: Gobierno, empresas y precios de los medicamentos
Columna de César Rodríguez en El Espectador. Datos Observamed
27jul13: 'Colombia nunca ha sancionado a una farmacéutica'
Carolina Gutierrez entrevista a Oscar Andia. Diario El Espectador.
25jul13: Gobierno pone freno a precio de 195 medicamentos
Salud, El Espectador. Usa datos OBSERVAMED. pdf-ACRR.
22jul13: Por fin los fármacos van a ser regulados.
Redacción Vivir de El Espectador. Usa datos OBSERVAMED. Ver pdf-ACRR.
|